
- •Введение
- •I. Ветеринарно - санитарная экспертиза туш и органов животных, подвергшихся радиационному воздействию
- •1. Порядок ветеринарного осмотра, сортировки и убоя животных, подвергшихся воздействию радиационных факторов.
- •2. Особенности ветеринарно-санитарной экспертизы туш и органов животных, подвергшихся радиационному воздействию.
- •3. Способы дезактивации животных и продуктов животноводства.
- •II. Ветеринарно – санитарная экспертиза туш и органов животных подвергшихся воздействию пестицидов (инсектоакарицидов).
- •1. Общие сведения.
- •2. Методы определения пестицидов (фоп, хоп, сп), содержащихся в органах и тканях животных, растениях, кормах.
- •3. Послеубойный осмотр. Лабораторная диагностика.
- •4. Пути реализации мяса, содержащего пестициды в количестве выше допустимых.
- •III. Ветеринарно-санитарная экспертиза туш и органов животных подвергшихся лечению антибиотиками.
- •1. Общие сведения.
- •2. Сроки убоя животных, подвергнутых обработке антибиотиками.
- •3. Определение содержания антибиотиков в мышечной ткани животных.
- •Приложения
2. Сроки убоя животных, подвергнутых обработке антибиотиками.
Животным, находившимся на выращивании и откорме, дачу антибиотиков с комбикормами прекращают за 7 дней до убоя. Если антибиотики назначали как лечебные препараты или вводили их в качестве профилактики заразных заболеваний, то их применение должно быть прекращено до убоя животных в следующие сроки: при использовании непролонгированных препаратов (бензилпенициллина, эритромицина, олеандомицина) – за 24 часа; хлортетрациклина, окситетрациклина, тетрациклина, левомицетина, полимицина – 72 часа; стрептомицина, канамицина, неомицина и мономицина – за 7 суток, а при применении антибиотиков пролонгированного действия: бициллинов – за 6 суток, дитетрациклина – за 25 суток и дибиомицина – за 30 суток.
3. Определение содержания антибиотиков в мышечной ткани животных.
В лаборатории ветеринарно-санитарной экспертизы МГУПБ была изучена чувствительность различных штаммов микроорганизмов к концентрациям основных видов антибиотиков, применяемых для лечения и откорма скота и птицы. На основании этих данных разработана методика, позволяющая определять количество антибиотических препаратов в продуктах животного происхождения, в частность мясе.
Сущность метода заключается в том, что адсорбирующие бумажные диски, смоченные изучаемым экстрактом из мышечной ткани мяса, бульоном и растворами антибиотика разной концентрации размещают на поверхности твердой питательной среды, содержащей тест – культуру. Тест – культурой называют штамм микроорганизма, который не способен расти в среде, в которой количество антибиотика ничтожно малое.
Рост тест – культуры при термостатировании приводит к помутнению агара. Отсутствие зоны помутнения вокруг диска с изучаемым образцом (нет роста микроорганизмов) свидетельствует о наличии в изучаемом субстрате антибиотического вещества. Диаметр этой зоны сравнивают с диаметром зоны отсутствия роста микроорганизмов вокруг дисков, содержащих разные концентрации антибиотиков.
Для подобных исследований следует использовать готовые и сухие среды, дистиллированную воду. Среды, реактивы и физиологический раствор не должны содержать ингибиторов микроорганизмов.
В проводимых исследованиях были использованы мясо – пептонный агар (рН среды после стерилизации – 7,2-7,4) и среда, состоящая из агар – агара – 20г, бульона Хоттингера (130 – 140 мг% аминного азота) – 1000 мл, глюкозы – 0,1% в виде 40% - ного раствора. Компоненты растворяли в бульоне и смешивали. Среду стерилизовали при температуре 120*С в течение 15 мин, рН среды после стерилизации составляла 7,2 – 7,4.
Основные растворы антибиотиков готовили из очищенных стандартных образцов препаратов. Использовали антибиотики, выпускаемые Всероссийским государственным научным контрольным институтом.
Для обнаружения в мышечной ткани и бульоне тетрациклина и неомицина использовали штамм B. subtillis L2. Культуру M. luteus АТСС 9341 применяли для обнаружения левомицетина.
Для приготовления тест – системы вносили 1 мл суспензии тест – культуры в 10 мл расплавленной агаризированной среды, приготовленной на бульоне Хоттингера, перемешивали и переносили в чашку Петри, расположенную на строго горизонтальной поверхности. Во избежание скопления конденсата, чашки с застывшим агаром в перевернутом вверх дном виде подсушивали в термостате. При исследовании в тушки птиц вводили тетрациклин, левомицетин и неомицин согласно инструкции по применению этих препаратов. Образцы для исследований отбирали в день последнего введения препарата и через 7 сут после этого.
От каждой тушки птицы были взяты образцы мышечной ткани из бедра до и после варки (тушку разрубали вдоль позвоночного столба на две половины и варили при 100*С в течение 1 ч).
Образцы отбирали согласно методам взятия проб для микробиологических анализов (ГОСТ №26668 – 85), затем очищали от серозных оболочек, взвешивали, измельчали, добавляли физраствор в соотношении 1:1 и тщательно перемешивали.
Кроме того, исследовали содержание антибиотиков в бульоне, полученном после варки тушек.
Образцы мышечной ткани выдерживали в течение 2 часов при комнатной температуре для экстракции антибиотика, периодически перемешивая, затем переносили его в пробирки и центрифугировали (при 3000 об./мин) в течение 10 минут. Надосадочную жидкость проверяли на наличие антибиотика.
На чашку Петри, содержащую агаризированную питательную среду, приготовленную на бульоне Хоттингера и суспензию тест – культуры, размещали по трафарету бумажные диски, смоченные в надосадочной жидкости, полученной от проверяемого образца, и в растворах антибиотика с концентрацией от 0,001 мкг/мл до 10 мкг/мл. Чашки термостатировали при температуре 37*С в течение 3 – 5 ч. После инкубации чашки просматривали в проходящем свете с целью определения размеров зоны задержки роста тест – культуры вокруг бумажных дисков.
Концентрация антибиотика в исследуемом образце должна быть равна концентрации в растворе, у которого зона отсутствия роста тест - культуры будет равняться зоне вокруг исследуемого образца.
Для расчёта антибиотической активности брали средние значения диаметров зоны отсутствия роста микроорганизмов одного и того же разведения как для антибиотика, так и для испытуемого гомогената. Например, при концентрации тетрациклина в растворе 0,001 – 10 мкг/мл были получены следующие средние значения диаметров зон (в мм): для 0,001 – 1,5, для 0,01 – 3,5, для 0,1 – 7,5, для 1 – 14, для 10 – 22.
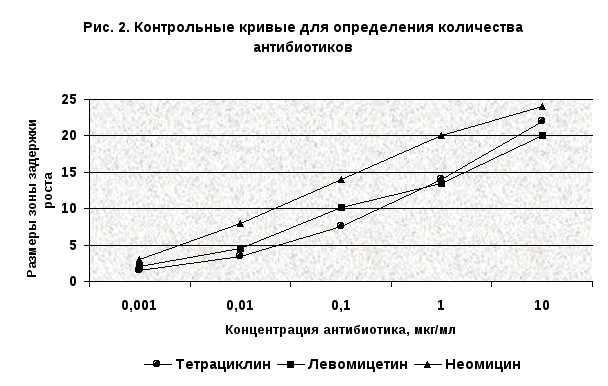 Используя
полученное данные, вычертили контрольные
кривые с помощью которых определяли
содержание антибиотиков в испытываемом
гомогенате мышечной ткани или бульоне
(рис. 1).
Используя
полученное данные, вычертили контрольные
кривые с помощью которых определяли
содержание антибиотиков в испытываемом
гомогенате мышечной ткани или бульоне
(рис. 1).
Диаметр зоны отверстия роста тест-культуры и содержание антибиотиков в исследуемых образцах представлены в таблицах 2 и 3.
Таблица 2.
|
Исследуемый продукт |
Содержание антибиотиков в тушке птицы в день последнего введения препаратов, мкг/мл |
Диаметр зоны отсутствия роста микроорганизмов под воздействием антибиотиков, мм | ||||
|
тетрациклин |
левомицетин |
неомицин |
тетрациклин |
левомицетин |
неомицин | |
|
Мышечная ткань: сырая после варки Бульон |
1,5 0,1 1,0 |
3,0 0,3 2,7 |
1,0 0,2 0,8 |
14,1 7,5 14,0 |
21,0 15,0 19,0 |
13,5 11,7 13,0 |
Таблица 3.
|
Исследуемый продукт |
Содержание антибиотиков в тушке птицы через 7 сут после последнего введения препаратов, мкг/мл |
Диаметр зоны отсутствия роста микроорганизмов под воздействием антибиотиков, мм | ||||
|
тетрациклин |
левомицетин |
неомицин |
тетрациклин |
левомицетин |
неомицин | |
|
Мышечная ткань: сырая после варки Бульон |
0,5 - 0,4 |
0,5 0,1 0,3 |
0,3 0,01 0,2 |
9,9 - 8,9 |
16,0 14,0 15,0 |
11,6 4,5 10,4 |
Опытом путём было установлено, что количество тетрациклина и неомицина в мышечной ткани бедра тушки птицы и в последний день введения препарата было второе выше, чем через 7 сут (содержание тетрациклина снизилось с 1,5 до 0,5 мкг/мл, а неомицина – с 1 до 0,3 мкг/мл). По истечению срока запрещения сдачи птиц на убой количество левомицетина уменьшилась в 6 раз (с 3 до 0,5 мкг/мл).
При варке тушек концентрация антибиотиков значительно уменьшилась. Так, содержание тетрациклина в мышечной ткани птицы, подвергшейся убою в последний день введения препарата, снизилось с 1,5 до 0,1 мкг/мл, т.е. на 93% (в бульон диффундировало 70% антибиотика, остальная часть – 23% была разрушена).
В мышечной ткани тушек птицы, подвергшейся убою через 7 сут после последнего введения антибиотиков, после варки тетрациклин не обнаружили. Причем 80% антибиотиков (0,4 мкг/мл) перешло в бульон, 20% антибиотиков было разрушено.
После варки содержание левомицетина снизилось соответственно на 90% и 80% в мясе птицы, подвергшейся убою в последний день введения препарата и через 7 сут; в бульон диффундировало соответственно 90% и 60% левомицетина.
Количество неомицина в мышечной ткани птицы, подвергшейся убою в последний день введения препарата, снизилось после варки соответственно на 80% и на 96%. В бульон перешло около 70% антибиотика. Часть была разрушена при варке (рис. 3 и 4).


Следовательно, предложенный метод определения содержания антибиотического препарата подтверждает, что с течением времени их количество в организма уменьшается, но семи суток, как принято, не достаточно для полного его выведения из мышечной ткани.
Варка при температуре 100*С в течение 1 часа позволяет снизить содержание антибиотика в мышечной ткани приблизительно на 70 – 80%. Большая часть препарата диффундирует в бульон, а около 10% при варке разрушается.
Таким образом, продукты убоя, содержащие повышенное количество антибиотика, могут быть использованы после варки при обычных параметрах обеззараживания и повторном контроле на содержание антибиотика в мышечной ткани.
Бульон содержит около 70% антибиотика от первоначального количества, потому на пищевые цели использоваться не может и должен быть утилизирован.
Предложенная методика по сравнению с общепринятой (МУ 3049-84) является более упрощенной. Она может быть использована в производственных условиях для определения остаточного содержания антибиотиков, например, в случаях при решении реализации мясного скота, подвергнутого вынужденному убою; при определении остаточных количеств антибиотиков-консервантов, применяемых против бактериальной порчи мяса во время его хранения и транспортировки; введение антибиотика в организм животного непосредственно перед убоем; а также во многих других случаях.
