- •Органическая, биологическая и физколлоидная химия
- •Часть I. Строение органических соединений
- •Оглавление
- •Предисловие
- •Лекция 1. Предмет и задачи биоорганической химии
- •Биополимеры и их структурные компоненты
- •Сравнительная характеристика органических и неорганических соединений и реакций с их участием
- •1861 Г. А.М. Бутлеров
- •Лекция 2. Изомерия органических соединений
- •Лекция 3. Химическая связь в органических соединениях
- •Валентные состояния атома углерода
- •Лекция 4. Концепция электронных смещений
- •Лекция 5. Методы исследования органических соединений
- •Основные понятия и термины
- •Библиографический список
Лекция 3. Химическая связь в органических соединениях
1. Электронное строение атома углерода;
2. Гибридизация атомных орбиталей;
3. Природа химической связи;
4. Типы химической связи.
|
В соответствии с квантово-химическими представлениями углерод в соединениях должен быть двухвалентным. |
|
|
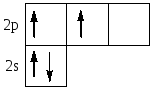
Однако, в подавляющем большинстве своих соединений атом углерода имеет валентность IV. Это происходит за счет разъединения («распаривания») пары электронов с 2s подуровня. |
|
При образовании химической связи выделяется энергия, поэтому появление двух новых валентных возможностей приводит к выделению дополнительной энергии (1053,4 кДж/моль), которая превосходит энергию, затраченную на распаривание 2s электронов (401 кДж/моль).
Различные по форме орбитали (s, p) при образовании связи смешиваются, давая новые равноценные гибридизованные орбитали (теория гибридизации, Л.Полинг, Д.Слэтер, 1928-1931 гг.). Понятие гибридизации относится только к молекулам, но не к атомам, и в гибридизацию вступают только орбитали, а не электроны на них.
В отличие от негибридизованных s- и p- орбиталей гибридная орбиталь полярна (электронная плотность смещена) и способна образовывать более прочные связи.

Валентные состояния атома углерода
|
Вал. сост. |
Взаимодействующие орбитали |
Простр. стр-ра |
Тип связи |
Вал. угол |
|
sp3 |
|
тетраэдрич. |
4 σ |
109°28' |
|
sp2 |
|
плоская |
3 σ, 1 π |
120° |
|
sp |
|
линейная |
2 σ, 2 π |
180° |
С изменением типа гибридизации углеродного атома меняются и его свойства. При переходе от sp3 к sp- возрастает доля s- орбитали в составе гибридизованного облака, что влечет за собой изменение его формы. Границы электронного облака приближаются к ядру в случае sp2 и sp- орбиталей, по сравнению с sp3- облаком. Это отражается на увеличении электроотрицательности атома углерода в ряду: sp3 < sp2 < sp. В связи с этим, уменьшается ковалентный радиус, увеличивается полярность связи.
Виды химической связи
Ионная связь
-возникает в случае полной отдачи электронов одними атомами и приобретением их другими. При этом атомы превращаются в ионы.
Ковалентная связь
- образуется путем обобществления электронов. Связывание атомов в молекуле осуществляется электронной парой, принадлежащей одновременно двум атомам. Обобществление электронов возможно двумя способами:
1) коллигация (обменный механизм);
2) координация (донорно-акцепторный механизм).
Существует два типа ковалентной связи: σ (сигма)- и π (пи)- связи.

σ-связью называется одинарная ковалентная связь, образованная при перекрывании атомных орбиталей по прямой (оси), соединяющей ядра двух связанных атомов с максимумом перекрывания на этой прямой.
π-связью называется связь, образованная при боковом перекрывании негибридизованных pz-атомных орбиталей с максимумом перекрывания по обе стороны от прямой, соединяющих ядра атомов.
Количественные характеристики ковалентной связи
1. Энергия связи – это энергия, выделяющаяся при образовании связи или необходимая для её разрыва.
2. Длина связи – это расстояние между центрами связанных атомов.
3. Полярность связи – неравномерность распределения электронной плотности.
4. Поляризуемость связи – смещение электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы.
Межмолекулярные взаимодействия