
- •Иммунология : практикум : учеб. Пособие / [Ковальчук л. В. И др.] - 2010. - 176 с. : ил.
- •1.1. Инбредные животные
- •1.2. Линии мышей с генетическими дефектами, затрагивающими иммунную
- •1.3. Линии мышей с аутоиммунной
- •1.4. Биологические материалы
- •1.5. Методические особенности работы
- •Глава 2 Методы разделения клеток периферической крови человека
- •2.1. Выделение лейкоцитов
- •2.2. Выделение мононуклеарных клеток
- •2.3. Выделение моноцитов
- •2.4. Выделение нейтрофилов
- •2.5. Аналитическая и препаративная цитофлуориметрия
- •2.6. Иммуномагнитная сепарация клеток
- •Глава 3. Методы изучения функциональной активности клеток иммунной системы in vitro и in vivo
- •3.1. Оценка пролиферативной активности лимфоцитов
- •3.2. Оценка клеточной цитотоксичности
- •3.3. Оценка функциональной активности
- •Глава 4 Иммуноанализы
- •4.1. Методы определения преципитатов антител с антигенами в геле
- •4.2. Иммуноферментный и радиоиммунный
- •4.3. Чувствительность, специфичность, диагностическая эффективность тест-систем иммуноанализов
- •4.4. Определение количества клеток, секретирующих тот или иной продукт, - метод elispot
- •4.5. Методы исследования внутриклеточных цитоплазматических и ядерных белков - факторов транскрипции, сигнальных молекул и других
- •Глава 5
- •Глава 6. Генетическая методы исследования в иммунологии.
- •6.1. Полимеразная цепная реакция
- •6.2. Исследование экспрессии генов методом микрочипов
- •6.3. Получение мышей с нокаутом
- •6.4. Применение регуляторных микро-рнк в иммунологических исследованиях
- •Глава 7
- •I. Оценка клеток-продуцентов.
- •II. Оценка цитокинов и их антагонистов в биологических средах организма.
- •III. Оценка клеток-мишеней.
3.2. Оценка клеточной цитотоксичности
Классический феномен цитотоксичности - способность Т-лимфоцитов распознавать клеточные элементы, несущие признаки генетической чужеродности (в частности, клетки, модифицированные вирусом, опухолевые клетки, аллогенные и ксеногенные клетки), и уничтожать их. NK-клетки, в отличие от Т-лимфоцитов, распознают как чужеродные клетки организма, утратившие антигены главного комплекса гистосовместимости (молекулы МНС). Другие клетки (например, В-лимфоциты, моноцитарно-макрофагальные клетки, эозинофилы, нейтрофилы и т.п.) также способны к цитотоксичности, но эта функция связана с привлечением антител против клеткимишени - КМ (антителозависимая клеточная цитотоксичность), цитокинов (ФНОа) и иных агентов. В физиологических условиях, т.е. в норме, цитотоксичность клеток иммунной системы направлена на разрушение и элиминацию стареющих и поврежденных клеток, таким образом обеспечивая клиренс многоклеточного организма от отживших клеток и продуктов их распада.
|
|
Основные клетки, обладающие цитотоксичностью, - антигенспецифические цитотоксические лимфоциты (ЦТЛ), NK (естественные киллеры), а также клетки миелоидного ряда (макрофаги, нейтрофилы).
Цитотоксическая активность клеток-киллеров реализуется при непосредственном синаптическом контакте лимфоцита (клеткиэффектора - КЭ) с КМ. При этом в КМ индуцируется апоптоз.
В зрелом дифференцированном цитотоксическом лимфоците формируются гранулы, содержащие перфорин и гранзимы. После образования синапса между КЭ и КМ гранулы концентрируются в области контакта и затем освобождаются в направлении КМ. Перфорин при контакте с мембраной КМ полимеризуется и встраивается в мембрану, формируя в ней пору диаметром около 100 Ǻ. В эту пору проникают гранзимы - ферменты, инициирующие апоптоз КМ.
Индукция апоптоза в КМ также может происходить через CD95 молекулы (другое название Fas), содержащие домен смерти. Лигандом CD95 служит молекула FasL (CD178), экспрессируемая на ЦТЛ, NK-клетках. В некоторых случаях КЭ сами становятся «жертвой» Fas-опосредованного апоптоза. Экспрессируя Fas-молекулы,
они могут проконтактировать с клетками, несущими Fas-лиганд, например, при потытке преодолеть гематоэнцефалический барьер. Повышенная экспрессия Fas (CD95) молекул на активированных лимфоцитах демонстрирует их способность к апоптозу при несостоявшихся физиологических процессах пролиферации и дифференцировки после активации. Считается, что такой процесс может привести к феномену, обозначенному как иммунодефицит, вызванный активацией (Ковальчук Л.В., Чередеев А.Н.).
В системе in vitro степень разрушения КМ приближается к лизису. Методов оценки функциональной активности ЦТЛ существует несколько, однако «золотым стандартом» до сих пор считается «хромовый тест». Под «хромом» имеют в виду соль хромата натрия, содержащую радиоактивный изотоп хрома - Na251CrO4, которую используют для мечения КМ. Такую метку подобрали опытным путем как относительно удовлетворяющую следующим критериям: свободно проникать в живые клетки и не выходить оттуда, пока клетка жива. Метка не вступает в прочные соединения с внутриклеточными структурами и имеет возможность выйти во внеклеточную среду из погибающей КМ.
|
|
Выбор КМ - отдельная творческая задача, которую экспериментально решают в соответствии с целями конкретного исследования. Чаще всего в качестве КМ используют опухолевые или зараженные вирусом клетки. Когда КМ выбраны, дальнейшая схема эксперимента кратко представляет собой следующее.
Лабораторная работа 3-1
1. 1х106 КМ инкубируют в среде, содержащей изотоп Na251CrO4 (37×105 Bq или 100 мкКю, специфическая активность 5 мкКю/моль), при 37 °С в течение 1-1,5 ч, после чего тщательно отмывают от не вошедшего в клетки изотопа.
2. КМ подсчитывают и раскапывают в подобранной дозе в лунки культуральных круглодонных микропланшетов.
3. В те же лунки вносят КЭ. Соотношение КМ и КЭ обычно составляет от 1:10 до 1:500 в пользу КЭ.
4. Плашки подвергают мягкому центрифугированию - 150 g в течение 1 мин, после чего помещают в СО2-инкубатор при 37 °С на 4-6 ч.
5. По завершении культивирования плашки центрифугируют при 250 g в течение 5 мин для плотного осаждения клеток.
6. Супернатанты собирают в специальные пробирки, в которых радиоактивность подсчитывают в γ-счетчике.
7. В качестве контроля используют:
а) лунки с КМ, в которые не вносят КЭ, - это контроль спонтанного выхода метки;
б) лунки с КМ, в которые вместо КЭ вносят детергент Triton X-100 1% (v/v), - это контроль максимально возможного высвобождения метки из КМ.
Цитотоксичность в опытных лунках рассчитывают обычно по следующей формуле:
 где
CPM - это число импульсов в минуту
соответственно в экспериментальных
лунках (СРМn),
в лунках со спонтанным высвобождением
метки (СРМспонтанно)
и в лунках с максимально возможным
высвобождением метки (CPMmax).
где
CPM - это число импульсов в минуту
соответственно в экспериментальных
лунках (СРМn),
в лунках со спонтанным высвобождением
метки (СРМспонтанно)
и в лунках с максимально возможным
высвобождением метки (CPMmax).
Оценка цитотоксической активности с использованием проточной цитометрии
Кроме описанного «хромового» теста, существуют методики оценки клеточной цитотоксичности с использованием проточного цитофлуориметра. В данном случае для мечения клеток используют два реагента. Сначала метят КМ флуорохромом, который проникает в клетки, не повреждая их, и флуоресцирует, возбужденный лазерным излучением. Затем к КМ добавляют КЭ, инкубируют их совместно, чтобы дать возможность реализоваться киллерной атаке, и добавляют к смеси второй реагент, превращающийся во флуорохром только в живых клетках под действием их ферментов-эстераз. В результате в итоговой картине КЭ станут светиться одним цветом «живого флуорохрома», живые КМ будут двухцветными, погибшие КМ - одноцветными по первому флуорохрому.
|
|
Известен метод оценки антителозависимой клеточной цитотоксичности с использованием в качестве КМ эритроцитов (например, барана), покрытых IgG- антителами к ним. КЭ, несущие Fc-рецепторы к IgG, разрушают (лизируют) КМ, и по уровню освобождаемого в культуральную среду гемоглобина судят об активности таких киллеров (NK, В-клетки, моноциты, макрофаги и др.).
Определение перфорина методом ELISPOT
Белок перфорин является необходимым компонентом лизиса, осуществляемого ЦТЛ и NK-клетками для уничтожения КМ. Метод ELISPOT (см. гл. 4) широко применяется для определения выработки цитокинов антигенспецифическими Т-клетками. Метод ELISPOT достаточно чувствителен для выявления перфорина после активации ЦТЛ соответствующими антигенными эпитопами, например вирусными (потенциально годен для использования любой эпитоп). При выполнении данного метода на дне лунки пластикового планшета фиксируются монАТ к перфорину. Недостаток метода - отсутствие возможности определить фенотип клеток, секретирующей перфорин, что частично компенсируется обогащением фракции ЦТЛ магнитной сепарацией. В экспериментах с использованием иммуномагнитной сепарации показано: основную популяцию клеток, образующих «пятна», составляют CD8+
Т-лимфоциты (80-90%).
Связывание с тетрамерными структурами MHC класса I
Конструирование тетрамерных комплексов MHC класса I обеспечило создание быстрого, специфичного и высокочувствительного метода выявления и подсчета антигенспецифических CD8+ Т-клеток с помощью проточной цитофлуориметрии. Тетрамер состоит из молекул MHC класса I, нагруженных специфическим антигенным пептидом, связанных с биотином, которые затем прикрепляются к стрептавидину, меченному флуорохромом - ФИТЦ, ФЭ и др. (рис. 3.1, см. также цв. вклейку). Тетрамеры MHC класса I связываются с CD8+ субпопуляцией Т-лимфоцитов. Созданы тетрамеры MHC класса II, связывающиеся с CD4+ Т-лимфоцитами. Тетрамерные структуры характеризуются сниженной способностью связывания с молекулой CD8. Однако сохраняют способность специфически связываться с TКР, обеспечивая точное узнавание антигенспецифических Т-клеток. Количество выявляемых данным методом антигенспецифических клеток составляет менее 1% от всех CD8+-клеток.
|
|
Отдельное использование тетрамерного связывания не дает информации о фенотипе клеток или функции ЦТЛ, поэтому целесообразно параллельно проводить определение внутриклеточного содержания цитокинов, хемокинов и цитотоксических эффекторных молекул (перфорина, гранзимов), фенотипа специфических CD8+ Т-лимфоцитов.
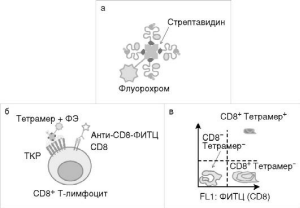 Рис.
3.1. Тетрамерные
структуры: а - строение тетрамерной
структуры; б - связывание тетрамера ЦТЛ;
в - пример результатов, полученных при
анализе тетрамерных структур на проточном
цитофлуориметре; ФИТЦ -
флуоресцеин-5-изотиоционат; ФЭ - фикоэритрин
Рис.
3.1. Тетрамерные
структуры: а - строение тетрамерной
структуры; б - связывание тетрамера ЦТЛ;
в - пример результатов, полученных при
анализе тетрамерных структур на проточном
цитофлуориметре; ФИТЦ -
флуоресцеин-5-изотиоционат; ФЭ - фикоэритрин
Использование методов цитофлуориметрического определения цитотоксической активности в комбинации с тетрамерным методом и иммунофенотипированием позволяет полно охарактеризовать популяции КЭ (ЦТЛ) и КМ. Данные методы - мощный инструмент для изучения кинетики киллерной активности ЦТЛ, они дают представление о фенотипе клеток и позволяют отслеживать физиологические изменения в КЭ и КМ
Определение каспаз методом проточной цитофлуорометрии
В результате запуска апоптоза, опосредованного перфорин/гран- зимовым и Fas/FasL механизмами, в КМ активируются каспазы. Данным методом определяют внутриклеточную активацию каспаз в КМ, используя белки, содержащие меченные флуорофором участки, подверженные расщеплению каспазами. Нерасщепленный флуорофор образует «молчащий» димер, после расщепления каспазами мономеры флуоресцируют.
Определение цитотоксической активности NK-клеток
NK составляют около 10-15% лимфоцитов периферической крови человека. NK - клетки врожденного иммунитета, в них не происходит перегруппировки генов I-клеточного рецептора (ТКР), кодирующих антигенраспознающие рецепторы. Функция NK - распознавание и уничтожение в организме клеток, пораженных вирусом, опухолевых клеток, лишенных МНС хозяина. NK проявляют функциональную активность без предварительной сенсибилизации и обладают так называемой естественной цитотоксичностью. Кроме того, NK способны уничтожать КМ, покрытые IgG антителами, вовлекая рецептор для IgG - FcγRIII (CD16). Такой тип цитотоксичности получил название антителозависимой клеточной цитотоксичности.
|
|
Функциональная активность NK оценивается по способности убивать КМ (например, клетки эритромиелоидной линии К562 человека, меченные радиоактивными изотопами 51Cr или 3Н-уридином).
Лабораторная работа 3-2
КМ К-562 метят изотопом 3Н-уридином (1 мкКи/мл) и инкубируют 1 ч при 37 °С. Затем клетки трижды отмывают культуральной средой, содержащей 10% СЭК. Отмытые КМ выдерживают в культуральной среде 2 ч при 37 °С и отмывают еще раз с целью удаления 3Н-уридина, не включившегося в РНК КМ. Готовят рабочую суспензию меченых КМ с таким расчетом, чтобы в 1 мл содержалось 1×106 КМ и 5 мкг панкреатической РНК-азы.
Цитотоксическую реакцию проводят в круглодонных 96-луночных микропланшетах. В каждую ячейку помещают по 100 мкл рабочей суспензии меченых КМ с РНК-азой и 100 мкл суспензии мононуклеарных клеток (рабочая концентрация - 1х107/мл). Используют различные соотношения КЭ:КМ - 100:1; 50:1; 25:1; 12,5:1. Клетки каждого разведения помещают как минимум в 3 лунки. В контрольных пробах меченые КМ инкубируют без мононуклеарных клеток.
Культуры инкубируют 14 ч при 37 °С и с 5% содержанием СО2. После инкубации содержимое лунок переносят на фильтры с помощью собирателя клеток - харвестра. Фильтры высушивают, помещают в сцинтилляционную жидкость, проводят учет реакции с помощью β-счетчика. Показатель функциональной активности естественных киллеров выражают в виде индекса цитотоксичности (ИЦ), который определяют по формуле:
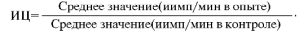 Оценка
функциональной активности NK-клеток с
использованием проточной цитометрии
Оценка
функциональной активности NK-клеток с
использованием проточной цитометрии
В качестве метки для КМ применяют флуоресцентный краситель 5-, 6-карбоксифлуоресцеин диацетатсукцинилмидиловый эфир (КФДЭ), который образует прочную ковалентную связь с внутриклеточными белками и в используемой концентрации не влияет на жизнеспособность клетки.
|
|
Первоначально нефлуоресцирующий КФДЭ проникает через клеточную мембрану. Карбоксифлуоресцеины связываются с внутриклеточными молекулами, формируя конъюгаты, обеспечивая стойкое флуоресцентное окрашивание клетки. Окрашенные таким образом КМ К-562 смешивают с КЭ и инкубируют в течение нескольких часов. После окончания культивирования клетки окрашивают пропидий йодидом для определения убитых в ходе реакции КМ. По количеству убитых К-562 определяют активность NK-клеток. Анализ проводят на проточном цитофлуориметре и определяют количество КМ, включивших КФДЭ (зеленое свечение), и количество убитых клеток, включивших пропидий йодид (красное свечение).
Антителозависимая клеточно-опосредованная цитотоксичность
In vivo случается чаще всего в патологических условиях и направлена на безъядерные клетки - эритроциты и тромбоциты, реже на ядросодержащие клетки крови, например нейтрофилы. Проявляются эти процессы в форме гемолитических анемий, тромбоцитопений, нейтропений. Этиология, как правило, либо инфекционная, либо лекарственная.
Комплементзависимая цитотоксичность
Микролимфоцитотоксический тест. Этот вариант иммунной цитотоксичности используют в качестве лабораторного теста в трансплантологии для оценки возможного наличия в крови реципиента антител к клеточным антигенам предполагаемого донора.
Тест проводят следующим образом.
1. У реципиента берут периферическую кровь, получают сыворотку и раскапывают, например, двукратные разведения этой сыворотки в лунки планшета.
2. У донора берут периферическую кровь, выделяют из нее лейкоциты или фракцию мононуклеаров (что лучше) и аликвоты клеток, например по 2×105 на лунку, раскапывают в лунки с разведениями сыворотки реципиента.
3. Планшеты инкубируют в СО2-инкубаторе при 37 °С в течение 45-60 мин.
|
|
4. Затем в лунки добавляют комплемент (заранее оттитрованную сыворотку кролика или морской свинки).
5. Продолжают инкубацию еще 30-45 мин.
6. Поврежденные клетки выявляют по включению суправитального красителя - трипанового синего, для чего из каждой лунки берут аликвоту клеток, добавляют к этой аликвоте 0,5% раствор трипанового синего и в камере Горяева подсчитывают число прокрашенных (поврежденных) и непрокрашенных (живых) клеток.
В случае если процент поврежденных клеток достоверно превышает таковой в контроле (т.е. в лунках, в которые не вносили сыворотку реципиента), то данный донор получает отвод.
После внедрения в клиническую практику трансплантологии этого теста трансплантологи значительно реже сталкиваются со случаями сверхострого отторжения трансплантатов.
В другом варианте микролимфоцитотоксический тест применяют для серологического типирования HLA специфичностей. Основные этапы теста указаны на рис. 3.2 (см. также цв. вклейку). В качестве КМ используют выделенные из крови пациента мононуклеарные клетки серотипирования HLA специфичностей класса I или очищенную фракцию В-клеток, например на колонке со стеклянной ватой, для тестирования специфичностей HLA класса II. Клетки инкубируют с панелью стандартных типирующих сывороток и после добавлениия комплемента определяют количество убитых и выживших клеток.
 Рис.
3.2. Микролимфоцитотоксический
тест (серотипирование HLA класса I)
Рис.
3.2. Микролимфоцитотоксический
тест (серотипирование HLA класса I)
