
- •Иммунология : практикум : учеб. Пособие / [Ковальчук л. В. И др.] - 2010. - 176 с. : ил.
- •1.1. Инбредные животные
- •1.2. Линии мышей с генетическими дефектами, затрагивающими иммунную
- •1.3. Линии мышей с аутоиммунной
- •1.4. Биологические материалы
- •1.5. Методические особенности работы
- •Глава 2 Методы разделения клеток периферической крови человека
- •2.1. Выделение лейкоцитов
- •2.2. Выделение мононуклеарных клеток
- •2.3. Выделение моноцитов
- •2.4. Выделение нейтрофилов
- •2.5. Аналитическая и препаративная цитофлуориметрия
- •2.6. Иммуномагнитная сепарация клеток
- •Глава 3. Методы изучения функциональной активности клеток иммунной системы in vitro и in vivo
- •3.1. Оценка пролиферативной активности лимфоцитов
- •3.2. Оценка клеточной цитотоксичности
- •3.3. Оценка функциональной активности
- •Глава 4 Иммуноанализы
- •4.1. Методы определения преципитатов антител с антигенами в геле
- •4.2. Иммуноферментный и радиоиммунный
- •4.3. Чувствительность, специфичность, диагностическая эффективность тест-систем иммуноанализов
- •4.4. Определение количества клеток, секретирующих тот или иной продукт, - метод elispot
- •4.5. Методы исследования внутриклеточных цитоплазматических и ядерных белков - факторов транскрипции, сигнальных молекул и других
- •Глава 5
- •Глава 6. Генетическая методы исследования в иммунологии.
- •6.1. Полимеразная цепная реакция
- •6.2. Исследование экспрессии генов методом микрочипов
- •6.3. Получение мышей с нокаутом
- •6.4. Применение регуляторных микро-рнк в иммунологических исследованиях
- •Глава 7
- •I. Оценка клеток-продуцентов.
- •II. Оценка цитокинов и их антагонистов в биологических средах организма.
- •III. Оценка клеток-мишеней.
4.2. Иммуноферментный и радиоиммунный
АНАЛИЗЫ
В основе самых распространенных на сегодня методов иммуноанализов, базирующихся на количественном определении растворимых веществ, лежит взаимодействие антигена с антителом (т.е. иммунологическое распознавание), которое детектируется (визуализуется) с помощью специальной метки, заранее конъюгированной либо с антителом, либо с антигеном. В качестве меток используют вещества, которые при определенных условиях тот или иной прибор может «увидеть» (зарегистрировать) и измерить количество метки. Физико-химическая чувствительность таких анализов обычно составляет нанограммы на миллиметр, но, применяя конкретные тест-системы, нередко выявляют пико- и фемтомоли определяемого вещества.
|
|
Варианты меток и материалов для твердой фазы
Метки
1. Радионуклид используется при радиоиммунном анализе (РИА).
2. Ферменты, катализирующие превращение бесцветного субстрата в цветной или флюоресцирующий продукт. В данном случае исследование называют иммуноферментным анализом (ИФА), его разновидность - анализ иммуноферментно-флюоресцентный.
3. Флюоресцирующие, люминесцирующие вещества и др.
В случае РИА результат измеряют на счетчиках радиоактивности в зависимости от того, какие частицы/кванты излучает конкретная метка-радионуклид. Результаты РИА нельзя зарегистрировать без соответствующих приборов. В случае ИФА при образовании цветного продукта результат реакции определяют с помощью спектрофотометра, измеряющего оптическую плотность. Без прибора, на
глаз, реакцию можно оценить приблизительно как положительную или отрицательную.
При использовании в качестве метки фермента, катализирующего образование флюоресцирующего продукта, результат реакции определяют на флюориметре, измеряющем излучение в определенном диапазоне длин волн. Без прибора в данном случае не обойтись.
Впервые методы РИА были разработаны в 1958 г. С. Берсоном и Р. Ялоу. Последняя удостоена в 1977 г. Нобелевской премии за РИА, позволившего впервые в мире определять нанограммовые концентрации пептидных гормонов в крови человека.
Менее чем через год после описания РИА в качестве метки стали использовать ферменты с бесцветными субстратами, но окрашенными продуктами. Метод назвали ИФА. По чувствительности и специфичности РИА и ИФА одинаковы, так как их показатели определяются в большей мере аффинностью взаимодействия антитела и антигена, а не типом метки. Однако ИФА применяют много чаще, чем РИА, ибо реагенты для ИФА существенно дольше остаются стабильными, а следовательно, технологию ИФА проще стандартизировать. В РИА используют непрерывно излучающие радионуклиды, и величина их удельной радиоактивности непрерывно же изменяется. Для мечения белков применяют радионуклиды йода (131I или 125I; γ-излучение), у которых период полураспада весьма короток, и реагенты необходимо обновлять примерно раз в месяц.
|
|
Сначала иммуноанализы разрабатывали в так называемых гомогенных вариантах (без разделения компонентов в растворе). Но вскоре в технологии иммуноанализов начали использовать твердую фазу, на которой методом спонтанной сорбции из раствора фиксируется антиген или антитело. Анализы стали называть твердофазными, или иммуносорбентными (англ. ELISA - Enzyme linked immunosorbent assay). Технологически твердофазные анализы несравнимо удобнее гомогенных тестов. В настоящее время твердофазные варианты ИФА применяют в 99,9% тест-систем.
В качестве «твердой фазы» используют следующие материалы:
1) пластмассу (полистирол, поливинилхлорид и др.) в виде стандартно штампованных микроплашек с 96 или 60 лунками (или шарики, колпачки и прочее - для постановки единичных проб);
2) пористые материалы типа нитроцеллюлозы в виде наполнителей в объеме или в виде плоских листов или полосок стрипов
(англ. strip); стрипы используют в методиках типа иммуноблота и иммунохроматографии; в пористых материалах существенно больше площадь, на которой сорбирован один из участников взаимодействия; другие реагенты диффундируют по порам.
Принцип иммуносорбентных анализов заключается в том, что на материале твердой фазы в соответствии с физико-химическими свойствами сорбируется антиген или антитело.
Белки хорошо сорбируются на подобранных для ИФА/РИА пластмассовых материалах. Если заданный антиген в силу своей химической природы (липид, углевод, липоили гликопроизводные белков) плохо сорбируется на выбранной твердой фазе, то подбирают вещество-«подложку», которое с одной стороны хорошо свяжется с твердой фазой, с другой стороны - с антигеном. Однако потребность в «подложке» возникает крайне редко.
Все остальные реагенты тест-систем используют в виде растворов. Их добавляют к твердой фазе поочередно, инкубируют, после чего несвязавшиеся реагенты легко удаляют промывкой твердой фазы. В этом главное технологическое преимущество твердофазного иммуноанализа. Результат реакции «остается» на твердой фазе и регистрируется количественно.
|
|
Существует много вариантов конструкций тест-систем для иммуноанализов. Мы разберем несколько базисных и более подробно объясним значения терминов.
Прямые иммуноанализы
Прямыми называют анализы, в которых метку присоединяют непосредственно либо к заданному антигену, либо к антителу, специфичному против искомого антигена.
Прямой вариант используют в гомогенных системах и некоторых гетерогенных: в конкурентном, ингибиторном, сэндвич-ИФА и иммуноферменто-метрическом анализе (рис. 4.5).
Ингибиторный иммуноферментный анализ
В ингибиторном ИФА (рис. 4.6) на твердой фазе иммобилизуют антиген. Растворимые антитела как реагент конъюгированы с ферментом. Определяемый антиген в испытуемой пробе конкурирует с иммобилизованным на твердой фазе антигеном за растворимые антитела. В итоге ферментативная активность, измеряемая на твердой фазе, обратно пропорциональна концентрации определяемого вещества в пробе.
Результаты ИФА показаны на рис. 4.7 (см. также цв. вклейку).
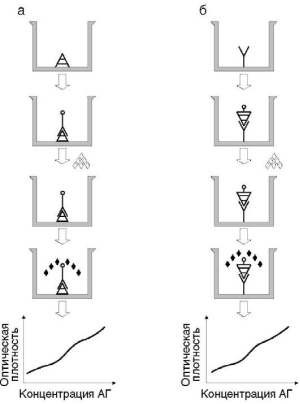 Рис.
4.5. Схема
постановки прямого метода ИФА: а - для
выявления антител; б - для выявления
антигена; АГ - антигены; АТ - антитела.
Рис.
4.5. Схема
постановки прямого метода ИФА: а - для
выявления антител; б - для выявления
антигена; АГ - антигены; АТ - антитела.
«Сэндвич»-ИФА
«Сэндвич»-ИФА (рис. 4.8) разработан для антигенов, на которых есть не менее двух неперекрывающихся эпитопов. Против обоих эпитопов получают в качестве реагентов специфичные антитела. Антитела к одному из эпитопов сорбируют на твердой фазе. Испытуемую пробу добавляют к твердой фазе, инкубируют, отмывают. После отмывки вносят конъюгат антител ко второму эпитопу с ферментом. Ферментативная активность, остающаяся на твердой фазе, прямо пропорциональна содержанию антигена в пробе.
«Сэндвич»-ИФА не требует препаратов очищенных антигенов, что выгодно отличает его от конкурентных и ингибиторных методик, поскольку чистые антигены всегда труднодоступны и дороги. Чувствительность «сэндвич»-ИФА потенциально выше, чем конку-
|
|
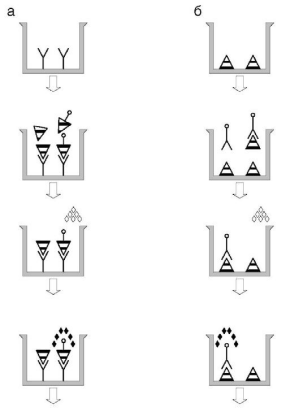 Рис.
4.6. Принцип
конкурентного (а) и ингибиторного (б)
ИФА
Рис.
4.6. Принцип
конкурентного (а) и ингибиторного (б)
ИФА
 Рис.
4.7. Планшет
с результатами ИФА
Рис.
4.7. Планшет
с результатами ИФА
рентных и ингибиторных. Аналогичная технология применима и с использованием одного антитела (и на твердой фазе, и в составе конъюгата с ферментом) в случаях наличия на заданном антигене повторяющихся эпитопов. В современных модификациях ту же технологию называют ловушечным ИФА (capture IA) - антитела на твердой фазе «ловят» свой антиген из смеси веществ в биопробе.
 Рис.
4.8. Принцип
«сэндвич»-ИФА
Рис.
4.8. Принцип
«сэндвич»-ИФА
Иммунометрический анализ
При иммунометрическом анализе (рис. 4.9) в пробирку с испытуемой пробой, предположительно содержащей определяемый антиген, вносят заведомый избыток меченых антител. Затем к этой смеси добавляют также заведомый избыток иммобилизованного на мелкодисперсной твердой фазе антигена. После инкубации центрифугированием отделяют растворимую фракцию (супернатант) и в ней измеряют ферментативную активность (если метка - фермент).
Ферментативная активность супернатанта прямо пропорциональна содержанию антигена в испытуемой биопробе. Благодаря использованию избытка реагентов этот метод более чувствителен, чем конкурентный ИФА, и его аналитические возможности приближаются к предельным.
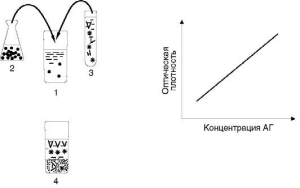 Рис.
4.9. Принцип
иммунометрических анализов: 1 - пробирка
с биопробой (сывороткой крови или др.);
2 - в пробирку с биопробой вносят заведомый
избыток чистого антигена, сорбированного
на мелкодисперсном твердофазном
носителе; 3 - затем в ту же пробирку вносят
заведомый избыток меченых антител; 4 -
материал инкубируют (чтобы реагенты
успели связаться), центрифугируют и в
супернатанте измеряют количество метки.
Величина сигнала в супернатанте прямо
пропорциональна содержанию искомого
вещества (антигена) в испытуемой пробе.
OD - optical density - величина оптической
плотности, измеренная спектрофотометром;
АГ - концентрация искомого антигена в
биопробах
Рис.
4.9. Принцип
иммунометрических анализов: 1 - пробирка
с биопробой (сывороткой крови или др.);
2 - в пробирку с биопробой вносят заведомый
избыток чистого антигена, сорбированного
на мелкодисперсном твердофазном
носителе; 3 - затем в ту же пробирку вносят
заведомый избыток меченых антител; 4 -
материал инкубируют (чтобы реагенты
успели связаться), центрифугируют и в
супернатанте измеряют количество метки.
Величина сигнала в супернатанте прямо
пропорциональна содержанию искомого
вещества (антигена) в испытуемой пробе.
OD - optical density - величина оптической
плотности, измеренная спектрофотометром;
АГ - концентрация искомого антигена в
биопробах
|
|
Непрямые иммуноанализы
Непрямые методики (рис. 4.10) применяют чаще, чем прямые.
Непрямым иммуноанализом называют анализ, в котором метку присоединяют не к целевому антигену и не к антителу против целевого антигена, а к так называемым вторым антителам - антивидовым антииммуноглобулиновым антителам, т.е. антителам к иммуноглобулинам того вида животных или человека, с биологическим материалом которого работают.
 Рис.
4.10. Принцип
непрямых иммуноанализов
Рис.
4.10. Принцип
непрямых иммуноанализов
Таким образом, один и тот же препарат конъюгата антиглобулиновых антител с ферментом используют в качестве проявляющего стандартного реагента в разных тест-системах для определения различных конкретных антигенов или антител.
Вместо антивидовых антиглобулиновых антител для конъюгации с ферментом может быть использован, например, протеин А стафилококка, который по своей природе с высокой аффинностью связывается с иммуноглобулинами класса G некоторых видов млекопитающих, включая человека. Все описанные схемы постановки прямого варианта ИФА (конкурентный, ингибиторный, «сэндвич», иммунометрический) применяют и в непрямом варианте.
Непрямые варианты ИФА не требуют очистки искомых антигенов или антител. Чистым должен быть только препарат антивидовых антииммуноглобулиновых антител.
В качестве ферментов-меток в ИФА используются следующие ферменты и субстраты для них.
1. Пероксидаза из корней хрена, субстраты:
• орто-фенилендиамин (продукт желто-коричневый, растворимый, поглощает при 492 нм);
• 3,3'-диаминобензидин (продукт коричневый, нерастворимый);
• 3-амино-9-этилкарбазол (продукт красный; нерастворимый);
• 5-аминосалициловая кислота (продукт коричневый, растворимый, поглощает при 405 нм);
• 2,2'-азино-бис(3-этилбензтиазолин)-6-сульфоновая кислота (продукт зеленый, растворимый, поглощает при 405 нм);
|
|
• 4-хлоро-1-нафтол(продуктголубой,нерастворим);3,3'-диметокси- бензидин (продукт желто-оранжевый, растворимый, поглощает при 405 нм);
• 3,3',5,5'-тетраметилбензидин (продукт голубой, растворимый, поглощает при 450 нм);
• ABTS - 2,2'-азино-ди(3-этилбензтиазолин)-6-сульфоновая кислота.
2. β-Галактозидаза (субстраты - дериваты β-галактозида, например 4-метилумбелиферил-β-D-галактозин).
3. Щелочная фосфатаза (субстраты: 5-бромо-4-хлоро-3-индолил фосфат в комбинации с голубым тетразолиевым, продукт голубой, нерастворимый; р-нитрофенил фосфат, продукт желтый, растворимый, поглощает при 405 нм).
4. Уреаза (субстрат - мочевина в комбинации с бромкрезолом пурпурным, продукт образуется очень быстро, пурпурного цвета, растворимый, поглощает при 590 нм).
Нерастворимые продукты ферментативных реакций используют в методах иммуногистохимии и иммуноблота, растворимые - в иммуноферментных анализах, в которых результат регистрируют количественно спектрофотометрически.
Встречаются оригинальные разработки с использованием других (кроме вышеперечисленных) ферментов-меток.
Если по тем или иным биохимическим причинам заданный антиген или интересующее антитело не удается конъюгировать с меткой без существенных потерь в аффинности их связывания, то в конструкцию тест-системы пробуют вводить дополнительные компоненты. Например, нередко используют так называемое «авидинбиотиновое» взаимодействие. Авидин - белок, выделяемый из «белка» куриных яиц, биотин - витамин Н (он же кофермент R). Авидин по своей природе с высокой аффинностью (Kd ~ 10-15 M) связывает биотин. Биотин легко конъюгируется с флюоресцеином. Кроме того, и против авидина, и против биотина получены высокоаффинные моноклональные антитела (существуют коммерческие
|
|
препараты). Соответственно все эти дополнительные компоненты используют при необходимости в конструкциях тест-систем, предназначенных для детекции того или иного заданного вещества. Сходным по аффинности сродством к биотину обладает также белок стрептавидин, выделяемый из грибов Streptomyces avidinii.
В конкретных вариантах тест-систем используют разные буферные растворы, соответствующие свойствам конкретных антигенов, ферментов и их субстратов. Для примера мы опишем последовательность действий и используемые реагенты при выполнении непрямого твердофазного иммуноанализа, его простой и часто встречающийся вариант, подходящий, в частности, для определения специфических противовирусных антител как маркера наличия в организме той или иной вирусной инфекции (специфическую лабораторную диагностику вирусных инфекций применяют для выявления инфицированности ВИЧ, вирусами гепатитов, герпеса, цитомегаловирусами и др.).
Лабораторная работа 4-2
Твердофазный непрямой иммуноферментный анализ
1. На твердую фазу стандартных 96-луночных планшетов сорбируют заданные антигены. В большинстве тест-систем используют в качестве антигенов либо рекомбинантные белки, либо синтетические пептиды, реже - компоненты лизата натуральных вирусов. Антигены растворяют до конечной концентрации 1-10 мкг/мл или опытным путем подбирают более подходящие концентрации, чаще всего в 0,05 М карбонат-бикарбонатном буфере при рН 9,6.
Для приготовления 1 л буферного раствора берут 0,015 М (1,59 г) Na2CO3 и 0,035 M, 94 г NaHCO3 и растворяют в воде.
Раствор АГ вносят в лунки планшетов в объеме 50-100 мкл.
Существуют другие варианты посадочных буферов, например фосфатно-солевой буфер, рН 7,2 (PBS).
Для приготовления 1 л раствора PBS берут 0,0025 М дигидрофосфата натрия (0,345 г NaH2PO4 × H2O, MW 137,99); 0,0075 М гидрофосфата натрия (2,68 г Na2HPO4 × 12 H2O, MW 358,14) и 0,145 М хлористого натрия (8,474 г NaCl, MW 58,44).
|
|
Время, отводимое на сорбцию, подбирают опытным путем. Как правило, достаточно 12-16 ч при комнатной температуре или при +4 °С.
2. Лунки планшета тщательно промывают фосфатно-солевым буфером или водой с детергентом (0,1% Tween-20) 5-10 раз. В современных лабораториях процедуры отмывки осуществляют в аппаратах типа «вошер» (англ. to wash - мыть).
3. В некоторых случаях на следующем этапе в лунки вносят 1% раствор бычьего сывороточного альбумина (БСА) или иного консервативного белка, например казеина, для так называемой «забивки» не покрытых антигеном площадей на дне лунок. Инкубируют 30-60 мин, после чего отмывают.
4. В лунки вносят исследуемые образцы биопроб в тех или иных разведениях. Для каждого разведения используют 2-3 лунки («параллели»). В качестве разводящей жидкости применяют PBS. В некоторых случаях в него добавляют 1% БСА. Инкубируют 1 ч и дольше. Время либо подбирают опытным путем, либо следуют инструкции к коммерческой тест-системе.
5. Отмывают (как описано выше).
6. Вносят конъюгат антииммуноглобулиновых антител с ферментом в заранее подобранном рабочем разведении или по инструкции к тест-системе. Инкубируют 1 ч.
7. Отмывают (как описано выше).
8. Вносят в лунки раствор субстрата того фермента, который входит в состав антииммуноглобулинового конъюгата. Если фермент - пероксидаза хрена, то субстратами могут быть ортофенилендиамин и перекись водорода. Эти субстраты растворяют в 0,1 М цитрат-фосфатном буфере, рН 5: цитрат χ H2O 0,0347 M (7,3 г/л, MW 210,14); гидрофосфат натрия 0,0667 M (Na2HPO4 × 12 H2O 23,87 г/л, MW 358,14).
На один планшет требуется 10 мл раствора. C небольшим запасом к 12 мл субстратного буфера добавляют 8 мг ортофенилендиамина и 5 мкл 30% перекиси водорода, быстро растворяют и раскапывают по лункам.
|
|
9. Через 15-30 мин в лунках, где произошла реакция «антиген- антитело», появится желто-коричневая окраска. Другие лунки останутся бесцветными. Для остановки ферментативной реакции в лунки вносят по 50 мкл 1 М раствора серной кислоты (55,5 мл 96 серной кислоты на 900 мл воды; строго добавлять кислоту в воду, а не наоборот!!!).
10. Интенсивность ферментативной реакции измеряют в единицах величины оптической плотности на спектрофотометрах, приспособленных для планшетов («мультисканах»). Для ортофенилендиамина
длина волны проходящего света должна быть 492 нм (для тетраметилбензидина - 450нм). В связи с этим в мультискане устанавливают соответствующий светофильтр.
11. Современные спектрофотометры оснащены программным обеспечением, в котором предусмотрен автоматический расчет средних значений между параллелями и сравнение опытных показателей с показателями в контрольных лунках. Если такого обеспечения нет, то результаты анализируют «вручную».
Оптическую плотность (OD - optical density) в контрольных лунках принимают за некий «фон». Эти показатели умножают на 2; такую величину условно принимают за «линию раздела» - границу (cut off) между положительными и отрицательными значениями OD: значения ниже «cut off» считают отрицательными, значения выше «cut off» - положительными, значения, близкие к «cut off», - неопределенными, или «серой зоной».
Метод иммуноблота
Метод иммуноблоттинга (первоначальное название Western blot, WB1) был разработан главным образом в целях обнаружения в сыворотках пациентов антител, реагирующих с отдельными белками возбудителей инфекционных заболеваний, чаще всего вирусов.
Метод представляет собой следующее.
|
|
1. В культурах клеток in vitro (в настоящее время, как правило, в промышленных масштабах) выращивают препаративные количества реплицирующихся вирусов.
2. Клетки разрушают (ультразвуком или иначе), вирусную массу выделяют из культуральной смеси методами ультрацентрифугирования.
3. Вирусные частицы диссоциируют на отдельные белки детергентами и подвергают электрофорезу в геле. В результате каждый вирусный белок в соответствии со своей молекулярной массой и электрическим зарядом занимает определенную позицию в геле. Без применения красок и специальных проявляющих реагентов фракционированные электрофорезом белки в геле не видимы глазу.
1 Впервые блестящая методическая идея «блоттинга» (переноса на «промокашку»; blot по-английски - пятно на промокашке) пришла в голову и была реализована применительно к электрофоретическому анализу ДНК биохимиком E.M. Southern в 1975 г. Из уважения к автору коллеги-биохимики воспользовались лингвистической особенностью фамилии Southern (южный) и тот же метод, примененный к РНК, назвали Northern blot (северный), а к белкам - Western blot (западный).
4. В целях существенной экономии дорогостоящих реагентов в дальнейшем фракционированные белки из геля «промокают», перенося таким образом на плоский пористый материал - нитроцеллюлозу. В производственных масштабах перенос продуктов электрофоретического разделения в геле на нитроцеллюлозу осуществляют также электрофорезом.
5. Лист нитроцеллюлозы с перенесенными на нее электрофоретически разделенными белками вируса нарезают на тонкие полоскистрипы (strip), соответствующие по формату специальным выпускаемым промышленностью пластмассовым «корытцам», в которых стрипы обрабатывают испытуемыми сыворотками и проявляющими реагентами.
|
|
6. Стрип заливают испытуемой неразведенной и разведенной 1:10 (или подбирают иные разведения) сывороткой, инкубируют 1 ч или более, тщательно промывают фосфатным солевым буфером с детергентом (0,1% Tween-20), заливают раствором конъюгата антииммуноглобулиновых антител с ферментом (например, пероксидазой хрена), инкубируют 1 ч, тщательно промывают, вносят раствор субстрата (например, ортофенилендиамина с перекисью водорода), после чего наблюдают, не проявятся ли окрашенные полосы в зонах расположения фракционированных вирусных белков.
В случае, если у человека в крови нет противовирусных антител, стрип остается неокрашенным (имеет место лишь неспецифический легкий фон по всей площади стрипа). Это отрицательный результат. Если окрашенными оказываются все полосы вирусных белков, результат квалифицируют как положительный. Если окрашиваются не все, а 1-2 полосы, результат рассматривают как неопределенный.
Ложноотрицательные результаты в иммуноблоте крайне маловероятны. Поэтому по международным соглашениям сертифицированные для клинической диагностики промышленно выпускаемые иммуноблоттинговые тест-системы приняты в качестве подтверждающих по отношению к планшетным и прочим скрининговым иммуноанализам. На рис. 4.11. представлена схема «сэндвича», приготовленного для блоттинга.
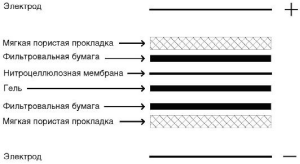 Рис.
4.11. Схема
«сэндвича», приготовленного для блоттинга
Рис.
4.11. Схема
«сэндвича», приготовленного для блоттинга
