
Lektsii_12
.doc
8.5. КАРБОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
8.5.1 АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ
В конце прошлого века В.В. Марковников, а позднее Н.Д. Зелинский и др. показали, что в нефти содержится значительное количество углеводородов состава СnH2n, насыщенных циклических углеводородов которые назвали нафтенами.
В настоящее время известны разнообразные карбоциклические соединения, которые различают в зависимостиот:
-
величины цикла – малые (С3 – С4 и их гомологи), средние (С5 – С10 и их гомологи), высшие (макроциклы – более С14);
-
числа циклов;
-
способа соединения циклов.
Номенклатура карбоциклических соединений.Названия циклических соединений образуются подобно углеводородам с приставкой цикло. Главной считают цепь углеродных атомов, формирующую цепь, направление отсчета выбирают в соответствии со старшинством заместителей:

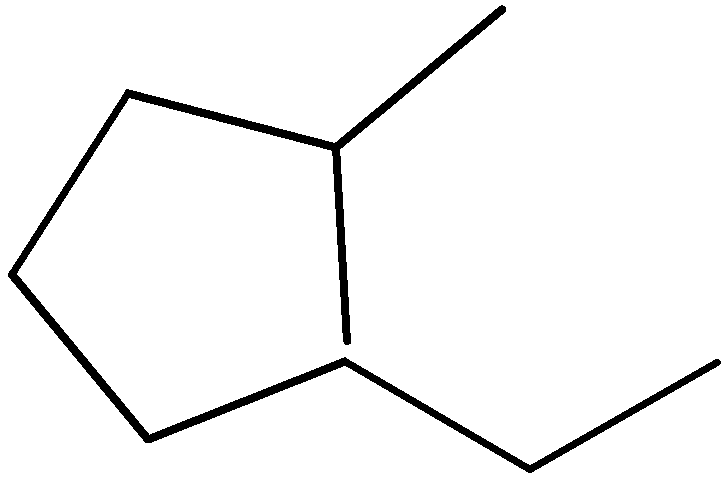
этилциклопропан 1-метил-2-этилциклопентан
Циклические соединения в зависимости от числа общих циклов называют би-, три-, тетрациклическими. Количество циклов определяется числом ковалентных связей, которые нужно разорвать для образования открытой цепи. В зависимости от способа соединения циклов различают:
-
спироуглеводороды (один общий углеродный атом);
-
мостиковые углеводороды (два и более общих углеродных атома).
Название спироуглеводородов образуют из названия углеводорода и цифрами в квадратных скобках указывают, сколько атомов углерода находится по каждую сторону от узлового атома. Нумерация начинается с меньшего цикла, узловой атом получает наибольший локант:
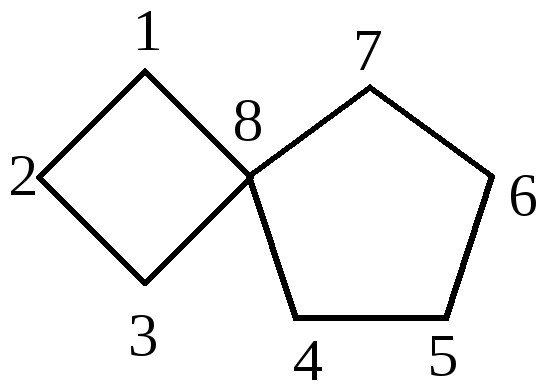

спиро[2,2]пентан спиро[3,4]октан
Н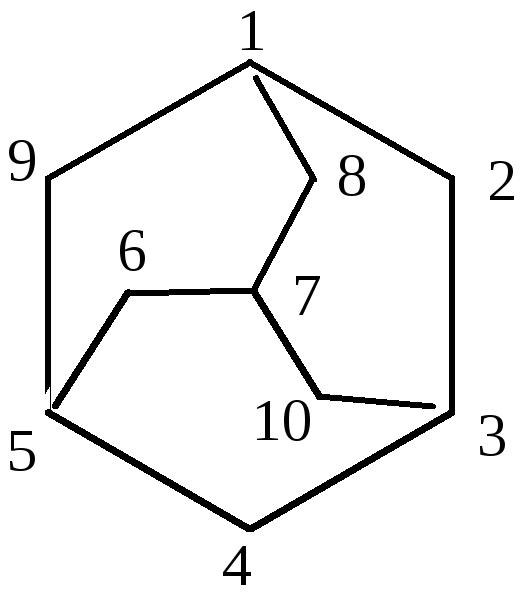 азвание
мостиковых углеводородов образуют из
названия углеводорода с указанием числа
циклов, в квадратных скобках указывают
число углеродных атомов в цепях, которые
мостиками соединяют узловые атомы и
число атомов в мостиках, в верхнем
индексе указывают локанты образующие
мостик. Нумерация начинается от одного
узлового атома к другому по большему
пути:
азвание
мостиковых углеводородов образуют из
названия углеводорода с указанием числа
циклов, в квадратных скобках указывают
число углеродных атомов в цепях, которые
мостиками соединяют узловые атомы и
число атомов в мостиках, в верхнем
индексе указывают локанты образующие
мостик. Нумерация начинается от одного
узлового атома к другому по большему
пути:
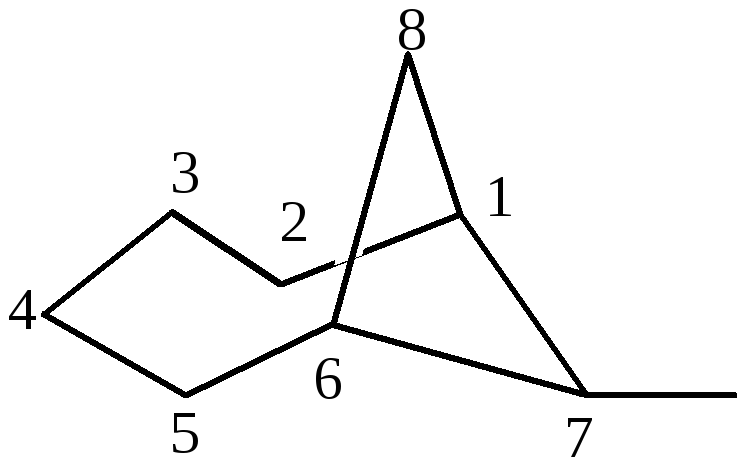
3-метилбицикло[4,1,1]октан трицикло[3,3,1,11,7]декан
адамантан
Изомерия карбоциклических соединений.
Структурная:
-
по числу атомов углерода в цикле;
-
скелетная изомерия радикалов;
-
по взаимному расположению радикалов в цикле;
-
по величине радикалов.
Пространственная:
-
конформационная;
-
геометрическая (для малых циклов);
-
оптическая (для малых циклов).
Способы получения карбоциклических соединений.
1. Из природных источников. Природным источником циклоалканов является нефть.
2. Циклизация α-,ω-дигалогеналканов (внутримолекулярный вариант реакции Вюрца):
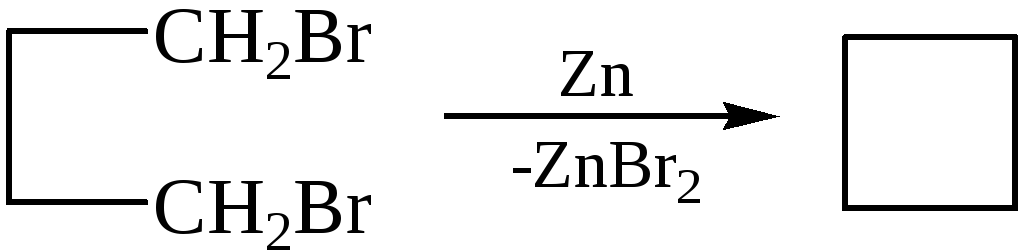
3. Взаимодействие дигалогеналканов с натриймалоновым эфиром (реакция Перкина):
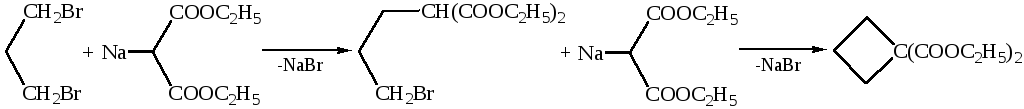
4. Из галогенкарбонильных соединений.Циклизация происходит под действием высоких температур либо щелочи:
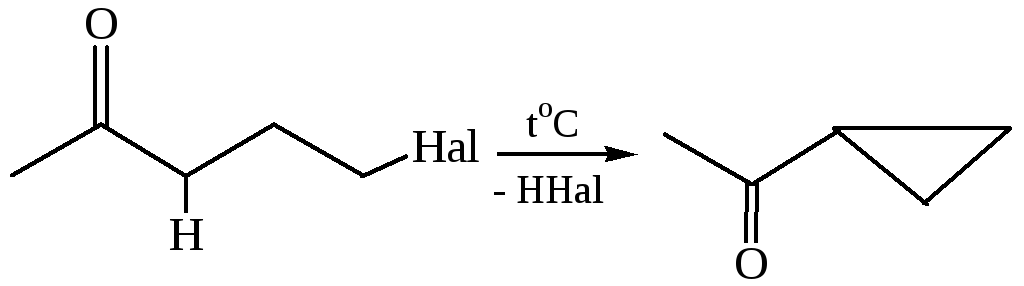
5. Декарбоксилирование солей двухосновных кислот (метод Ружичка):
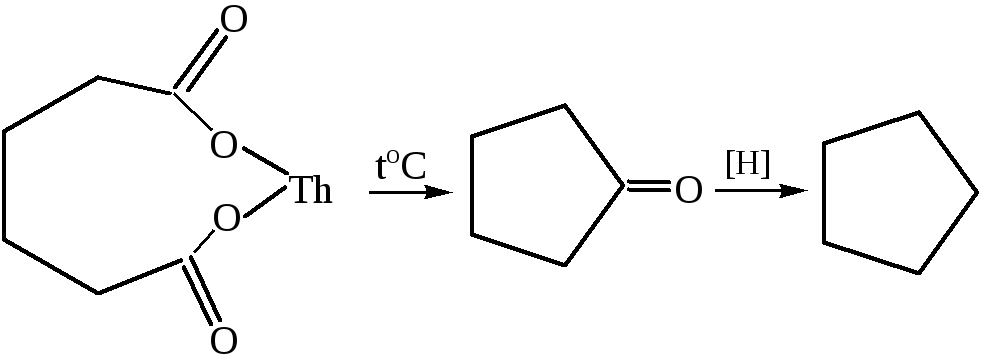
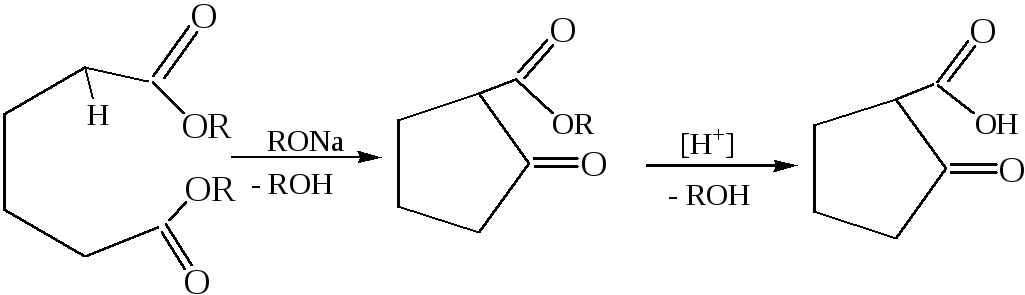
6. Сложноэфирные конденсации с участием эфиров двухосновных кислот под действием алкоголятов:
6.1 Межмолекулярная конденсация:

6.2 Внутримолекулярная конденсация:
7. Реакции циклизации непредельных углеводородов (глава 8.3–8.4)
8. Гидрирование ароматических соединений:
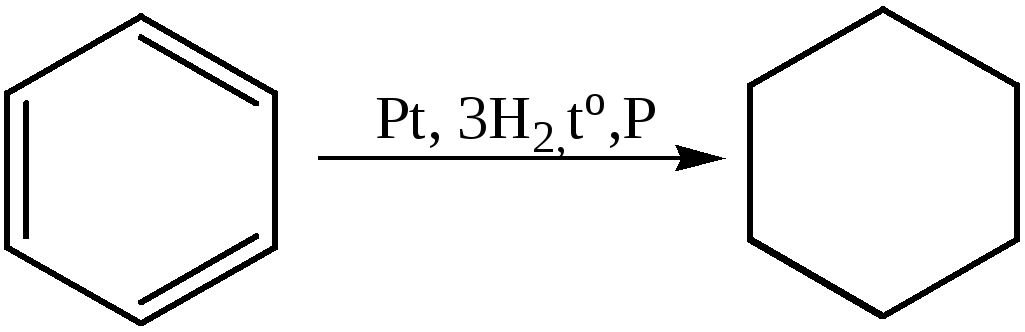
Физико-химические свойства карбоциклических соединений. По физическим свойствам циклоалканы близки к углеводородам алифатического ряда. С3-С4 – газообразные вещества, начиная с циклопентана – жидкости, с температурами кипения и плотностью немногим выше, чем у соответствующих по массе алканов.Как неполярные так и малополярные соединения циклоалканы не растворяются в воде, но растворимы в четыреххлористом углероде, лигроине, эфире.
Химические свойства циклоалканов зависят от размера цикла. Низшие – напоминают по своим свойствам алкены, а циклопентан и большие циклы – алканы.
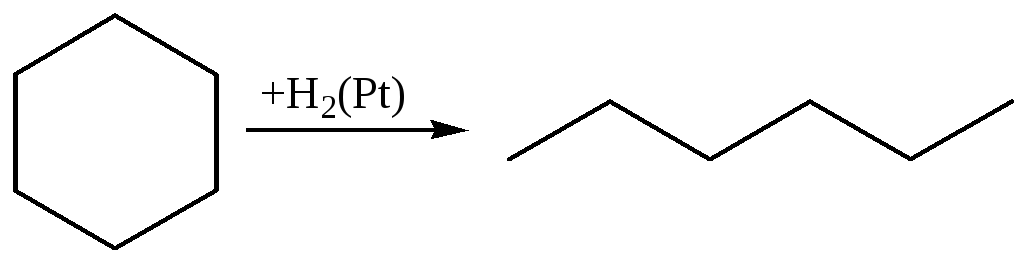
1. Гидрирование:
2. Действие галогенов. Реакция протекает в различных направлениях, в зависимости от величины цикла:
2.1 Реакция присоединения:
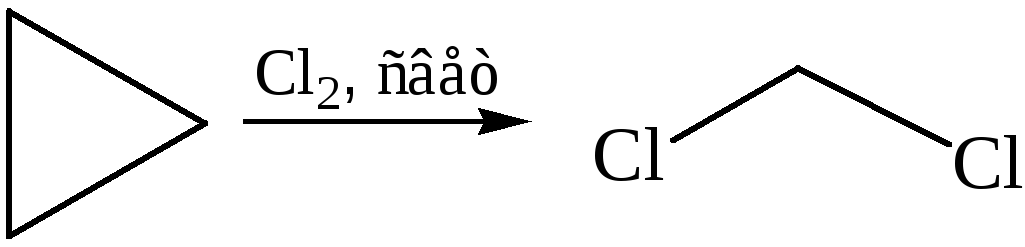
2.2 Реакция замещения:
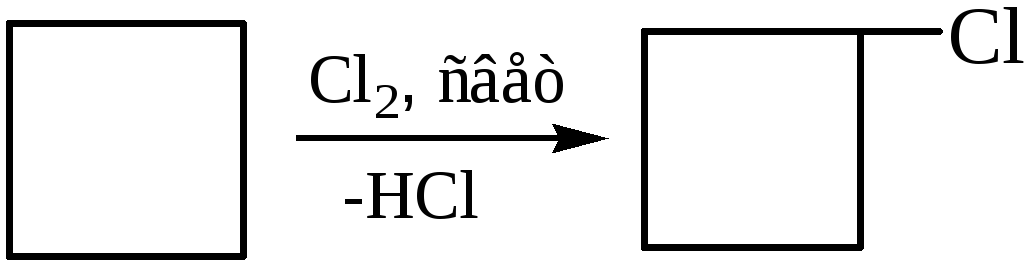
3. Действие галогенуглеводородов:

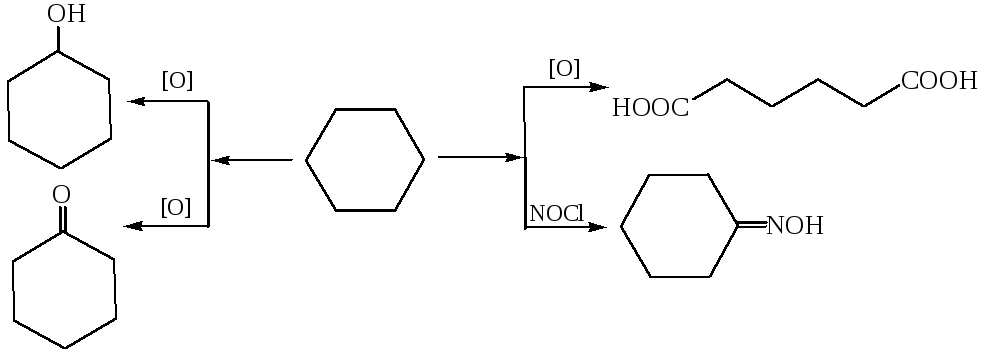
4. Окисление. Алициклы более устойчивы к действию окислителей, чем алкены. Устойчивость повышается с увеличением цикла. При действии энергичных окислителей (перманганата калия, хромовой кислоты, концентрированной азотной кислоты) возможно образование спиртов и кетонов, которые могут быть окислены с образованием двухосновных карбоновых кислот:
5. Действие высоких температур:
5.1 Расщепление малых циклов с образованием непредельных соединений:
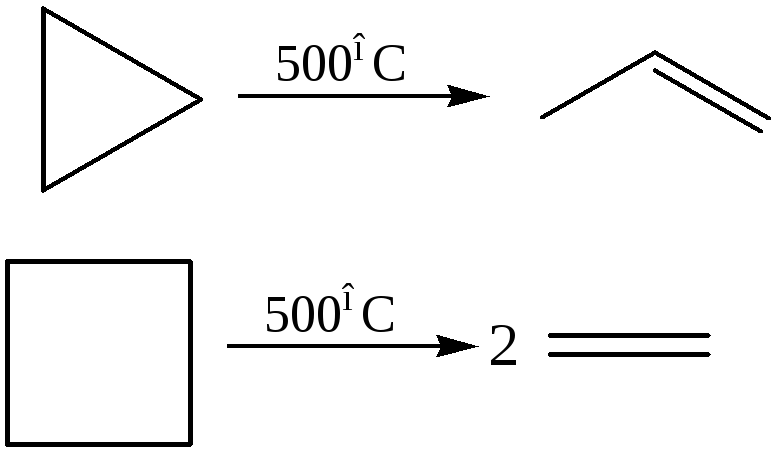
5.2 Дегидрирование:
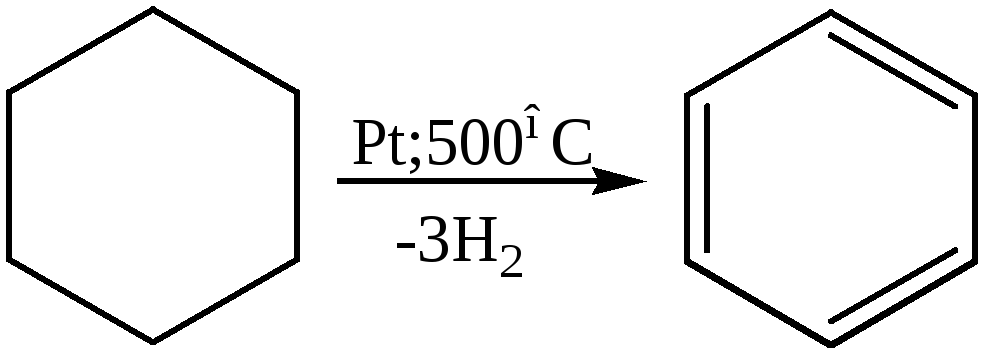
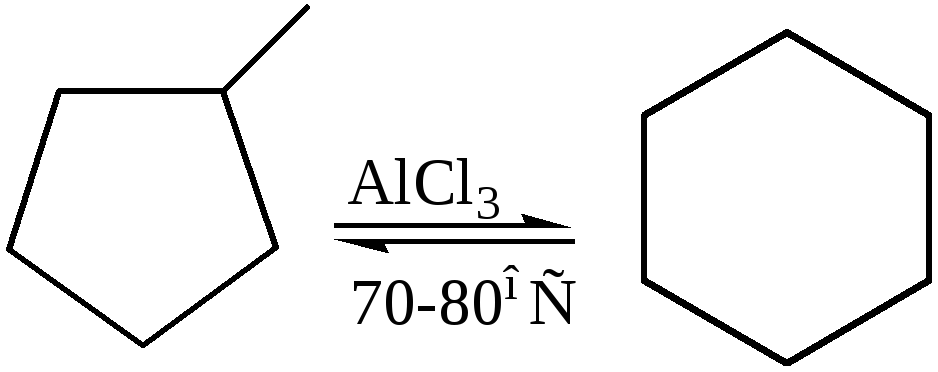
5.3 Изомеризация:
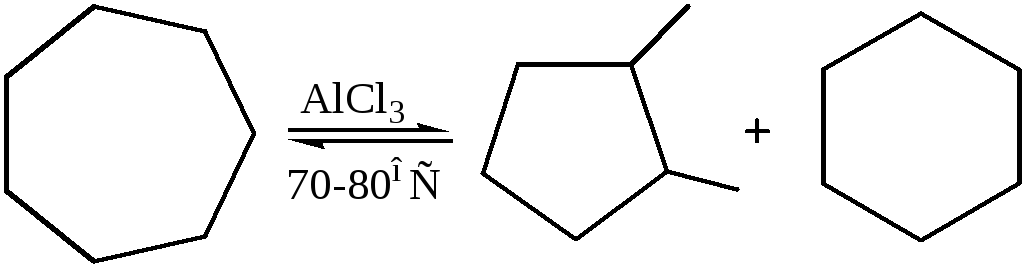
Применение циклоалканов. Циклоалканы находят широкое практическое применение. Циклопропан и его фторпроизводные используют в медицине для ингаляционного наркоза. Эфиры циклопропанкарбоновой кислоты – средства химической защиты растений. Циклогексан используется в качестве сырья в органическом синтезе, служит растворителем эфирных масел, красок, восков, лаков и экстрагентом в фармацевтической промышленности. Его производные – циклогексанол и циклогексанон – полупродукты в производстве адипиновой кислоты, капролактама и синтетических волокон (капрона и найлона) и находят широкое применение в качестве растворителей, противовспенивателей, стабилизаторов эмульсий и т. п.
Циклоалканысодержатся в нефти и вырабатываются некоторыми видами растений. Из антропогенных источников поступления в окружающую среду следует, прежде всего, назвать предприятия по производству капролактама и некоторых других синтетических материалов, а также выхлопные газы автотранспорта. В природе циклоалканы, как и алканы, подвергаются микробиологическому окислению.Наркотизирующий эффект у циклоалканов более выражен, чем у соответствующих алканов. Многие из них вызывают судороги, которые могут привести к смерти в результате остановки дыхания и падения кровяного давления.
Высшие циклоалканы, начиная с циклопентана, вызывают воспаление кожи, причем эта реакция возрастает с увеличением количества атомов углерода (С5–С12).
Циклопропан при попадании в организм человека не разрушается, выделяясь в неизменном виде через легкие, кожу и с мочой. Высшие циклоалканы, начиная с циклопентана, подвергаются биотрансформации. При этом с увеличением размеров молекулы уменьшается количество образующихся метаболитов. Циклогексан в организме окисляется в микросомах печени в циклогексанол и циклогексанон. При биотрансформации метилциклогексана происходит окисление по С4, а затем 4-метилциклогексанол в комплексе с глюкуроновой кислотой выводится с мочой.
Соединения, содержащие в своей структуре ядра циклоалканов широко распространены в природе. Некоторые циклопарафины найдены в составе нефти. Известна большая группа веществ растительного происхождения – терпенов, входящих в состав эфирных масел, выделяемых из цветов, фруктов, листьев, древесины (глава 8.3.2)
