
- •3. Основные понятия о реакционной способности органических молекул
- •1. Концепция теории мезомерии.
- •2. Концепция теории резонанса (Полинг, 1928 г.).
- •3. Делокализованное π-облако изображается пунктиром (в цикле – сплошной линией).
- •4. Классификация химических реакций и промежуточных частиц
- •Стабилизация интермедиатов.
- •Примеры построения названий по систематической номенклатуре
- •7. Кислотные и основные свойства органических соединений
- •Кислотные и основные функции веществ
- •Кислотность и основность по Бренстеду-Лоури.
- •Примеры.
- •Кислотность спиртов.
- •Сольватация аминов.
- •Кислоты и основания Льюиса.
- •Жесткие и мягкие кислоты и основания по Пирсону (жмко).
- •8. Углеводороды
- •8.1 Алканы
- •5. Воздействие анаэробных бактерий на растительные остатки:
- •6.1 Гидролиз карбидов:
- •7.1 Гидрирование алкенов:
- •7.2 Гидрирование алкадиенов:
- •7.3 Гидрирование алкинов:
- •1. Реакции замещения атомов водорода при взаимодействии с активными радикалами.
- •1.1.1 Фтор:
- •1.1.3 Бром:
3. Основные понятия о реакционной способности органических молекул
Химические реакции представляют собой процессы, в которых происходит перераспределения электронов. Направление (образование определенных продуктов) и механизм реакции в существенной степени зависят от распределения электронов, вступающих во взаимодействие молекул. Обычно, электронная плотность в молекулах распределена неравномерно, что связанно с целым рядом факторов.
Прежде всего, распределение электронов находится в зависимости от природы связанных атомов и взаимного влияния их друг на друга.
Электронодонорные заместители (ЭД) – заместители, увеличиваю-щие электронную плотность в системе.
Электроноакцепторные заместители (ЭА) – заместители, умень-шающие электронную плотность в системе.
В молекулах осуществляется взаимное влияние не связанных атомов, которое может реализовываться двумя путями. В связи с этим различают два механизма электронных смещений в молекуле: индуктивное влияние (индукционный эффект); мезомерный эффект или эффект сопряжения.
Индуктивный эффект. Понятие индуктивного эффекта было предложено Дж. Льисом. Индукционный эффект состоит в передаче влияния путем последовательной поляризации σ-связей и распространяется вдоль цепи связанных атомов по механизму электростатической индукции.
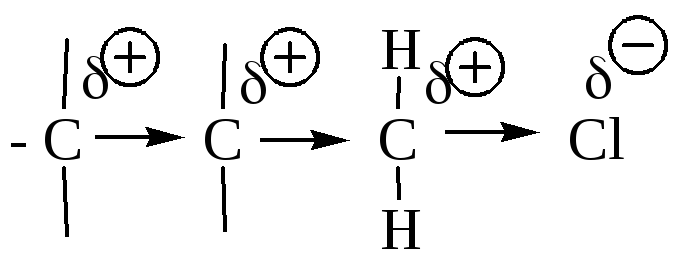
Характерная особенность индуктивного механизма передачи влияния атомов в молекуле состоит в том, что все смещаемые электронные пары σ-связей остаются на своих первоначальных октетах. Изменения касаются только их положения относительно связанных атомов.
Индукционный эффект оказывает воздействие на все атомы насыщенной цепи в одном направлении.
Направление индуктивного влияния определяют по частичному заряду, который приобретает заместитель (Х), его вызывающий.
|
|
Н–СR3 |
|
|
–I |
IH = 0 |
+I |
Индукционный эффект атома водорода принят равным нулю. Сила индукционного эффекта зависит от природы заместителя, а именно от его электроноакцепторых или электронодонорных свойств. Для электроно-акцепторых заместителей –I эффект возрастает с электроотрицательностью атома и увеличением числа электроотрицательных атомов.
Электроотрицательность атома галогена возрастает от йода к фтору. Соответственно, усиливается вызываемый ими –I эффект, и увеличиваются кислотные свойства галогензамещенных карбоновых кислот.
Ненасыщенные группы обнаруживают слабый –I эффект. Причина такой зависимости состоит в увеличении электроотрицательности атома углерода, связанного с карбоксилом, и изменением типа его гибридизации от sp3 к sp2 и sp.
Насыщенные алкильные радикалы вызывают слабый +I. При этом +I алкильного радикала возрастает с увеличением длины цепи и степени его разветвленности:
|
СH3– < СH3–СH2– < СH3–СH2–СH2– < (СH3)2СН– < (СH3)3С– |
|
увеличение +I |
Учитывая указанные взаимоотношения, различные заместители можно объединить в ряд индуктивного влияния относительно атома водорода:
|
–NO2, –+NH3, –F > –OR > –NR2 > –C≡CR > –C6H5 > –CH=CR2 > H(IH = 0) |
|
ослабление –I |
|
О-– > (СH3)3С– > (СH3)2СН– > СH3–СH2– > СH3– > H(IH = 0) |
|
ослабление I |
Однако, влияние
конкретного заместителя зависит от
окружения. Так, в металлорганических
соединениях, в силу ярко выраженных
электронодонорных свойств металла,
электронодонорная пара связи сильно
смещена к алкильному радикалу R![]() Ме.
Ме.
Еще одной характерной чертой индукционного эффекта является его быстрое затухание по цепи простых связей. Этим объясняется резкое убывание кислотных свойств в ряду α-, β- и γ-хлормаслянных кислот.
Мезомерный эффект (эффект сопряжения, резонансный эффект). Мезомерный эффект представляет собой механизм передачи взаимного влияния атомов, не связанных друг с другом. Под действием мезомерного эффекта происходит перераспределение электронной плотности в молекуле. Однако, в отличие от индуктивного влияния это перераспределение осуществляется не через систему σ-связей, а главным образом с участием π- и p-электронов (НЭП). Более того, если при индуктивном влиянии σ-электроны частично смещаются относительно исходных положений, то в случае мезомерного эффекта происходит частичное перемещение электронных пар в соседние октеты, вызывающее аналогичное отталкивание взаимодействующих электронных пар вдоль цепи π-связей вплоть до крайнего атома, на котором локализуется избыток электронной плотности.
Подобное перемещение с точки зрения квантовой химии осуществляется в результате перекрывания соответствующих атомных орбиталей. Поэтому мезомерный эффект можно определить как перераспределение электронной плотности путем перекрывания π-электронных облаков с соседними π- и p- или σ-С–Н-электронными облаками и образовании в результате общего π-электронного облака, в составе которого происходят электронные смещения. Условием такого перекрывания является параллельность и пространственная близость соответствующих орбиталей.
Мезомерный эффект может быть неполярным, положительным и отрицательным.
Направление эффекта определяется, как правило, по знаку частичного заряда, появляющегося на заместителе, ответственном за данный М:
|
|
|
|
|
+М |
М |
–М |
|
винилхлорид |
1,3-бутадиен |
акролеин |
В отличие от индукционного мезомерный эффект передается по системе π-связей практически не ослабевая, стабилизируя молекулу и понижая ее систему. Мезомерный эффект оказывает сильное влияние на строение молекул, их свойства и реакционную способность.
Например:
+М в винилгалогенидах –I приводит к уменьшению полярности молекулы и снижению ее реакционной способности;
–М в акролеине –I усиливает полярность этой молекулы по сравнению с аналогичными производными предельного ряда.
Особое положение в ряду различных видов мезомерного эффекта занимает σ, π-сопряжение или сверхсопряжение (гиперконъюгация). Перекрывание является частичным и неэффективным и происходит в силу поляризуемости σ-молекулярной орбитали С–Н-связи:
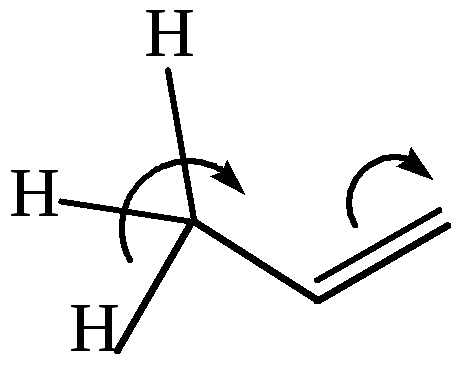
Оно значительно слабее π, π- и p, π-сопряжения, т. к. перекрываются π-электронные облака двойной связи с облаками соседних σ-С–Н-связей. Следовательно, мезомерный эффект ослабевает при переходе от метильного радикала к более разветвленным радикалам с большей длины цепи:
|
СH3– < СH3–СH2– < СH3–СH2–СH2– < (СH3)2СН– < (СH3)3С– |
|
убывание +М возрастание +I |
Для объяснения мезомерного эффекта К. Ингольд (1926 – 1933 г.) разработал представление о мезомерии (гр. meso – между, meros – часть), согласно которому распределение электронной плотности в реальной сопряженной молекуле является промежуточным между двумя структурами. Полярные сопряженные системы могут быть изображены при помощи нескольких граничных формул. Первые предложения о своеобразном распределении электронов в сопряженных системах (о мезоформе) принадлежат русскому химику В.А. Измальскому (1915 г.).
Графические способы описания делокализации электронов в сопряженных системах.
