
- •8.2 Алкены
- •3. Дегалогенирование вициальных дигалогеналканов:
- •5. Восстановление алкадиенов и алкинов:
- •7.2.4 Реакция Хека:
- •8. Реакции окисления.
- •10.1 Катионная полимеризация:
- •10.2 Анионная полимеризация:
- •10.3 Радикальная полимеризация:
- •8.3 Алкадиены
- •2. Получение алкадиенов-1,2 (аллены)
- •2.2.1 Присоединение галогенводорода:
- •2.2.2 Присоединение галогена:
- •2.2.3 Присоединение воды:
- •8.3.1 Каучук
- •8.3.2 Природные изопреноиды. Терпены
- •8.4 Алкины
- •4. Реакции отщепления.
- •1. Реакции присоединения.
- •1.1 Реакции электрофильного присоединения.
- •1.1.3 Гидрогалогенирование:
- •1.2 Реакции нуклеофильного присоединения:
- •2. Реакции окисления.
8.2 Алкены
Алкенами называются ненасыщенные линейные углеводороды, содержащие одну двойную связь и отвечают общей формуле – СnН2n. Простейшим алкеном является этилен С2Н4, остальные углеводороды этого ряда рассматривают как его производные. Исторически первое название алифатических углеводородов с двойной связью – олефины (маслообразующие, т. к. при взаимодействии с хлором и бромом образовы-вали маслянистые жидкости).
Номенклатура алкенов. Простейшим соединением ряда алкенов является этен С2Н4.
Для названия алкенов используют следующие номенклатуры:
тривиальную;
рациональную;
систематическую.
Тривиальная. Как и в ряду алканов, для первых членов гомологического ряда широко используются тривиальные названия этилен СН2=СН2, пропилен СН2=СН–СН3, бутилен СН2=СН–СН2–СН3, псевдобутилен СН3–СН=СН–СН3.
Рациональная. В рациональной номенклатуре олефины рассматривают как алкилзамещенный этилен, обозначая положения заместителей словами симметричный или несимметричный, либо символами α или β.
Систематическая (заместительная, международная, ИЮПАК). Систематическое название строят, принимая за главную цепь самую длинную углеродную цепь, содержащую двойную связь, которую обозначают суффиксом -ен. Нумерация цепи начинается со стороны, к которой ближе расположена двойная связь.
Изомерия. Для алкенов характерны следующие виды изомерии:
Структурная:
скелетная;
изомерия положения;
метамерия.
Пространственная:
геометрическая.
Способы получения. Низшие алкены в небольших количествах могут входить в состав нефтяного газа, высшие – в состав некоторых нефтей. Непредельный характер имеет целый ряд феромонов. Так, половой аттрактант самки домашней мухи представляет собой алкен С23Н46-(Z)-трикозен-9 (мускулар):
![]()
Е-изомер этого соединения не активен и не является феромоном.
Промышленные способы:
1. Получение из нефти. Низшие алкены С2 – С4 можно получить при переработке нефти. Среди газообразных продуктов пиролиза и крекинга нефти, содержание алкенов может достигать 50%. Алкены С5 – С10, которые нельзя выделить из сложной смеси после крекинга, входят в состав бензина. Образование алкенов в процессе крекинга и пиролиза основано на реакциях свободных радикалов (см. термические превращения алканов).
1.1. Каталитическая дегидрогенизация (дегидрирование) алканов. (450 – 460оС, катализатор – смеси оксидов металлов (алюминия, хрома, железа и др.):

Лабораторные методы:
2. Дегидрогалогенирование галогенпроизводных алканов. Для элиминирования галогеноводорода требуется сильное основание – спиртовой раствор щелочи. Атом водорода преимущественно отщепляется от наименее гидрогенизированного атома (правило Зайцева):

3. Дегалогенирование вициальных дигалогеналканов:
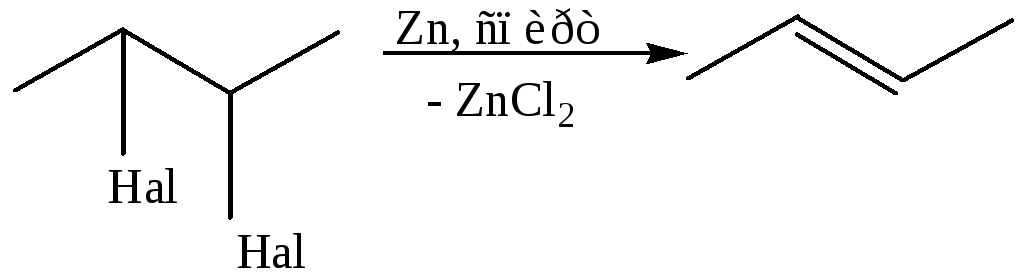
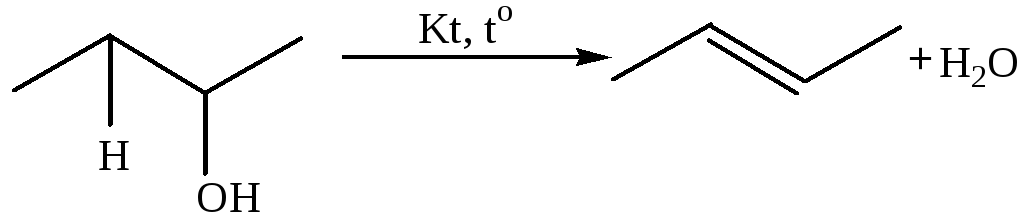
4. Дегидратациая спиртов (водоотнимающий агент, 150–200оС; оксид алюминия при 350–400оС):
5. Восстановление алкадиенов и алкинов:
5.1
![]()
5.2
![]()
6. Реакция конденсации. Алкены и их производные получают при взаимодействии двух соединений с активными группами (например, карбонильной, метиленовой и др.). Общая схема реакции:

6.1. Реакция фосфонийилидов с сильными нуклеофильным реагентами (реакция Виттига):
(С6Н5)3Р=СН2
+ О=С(R)2
![]() (С6Н5)3Р=О
+ СН2=
С(R)2
(С6Н5)3Р=О
+ СН2=
С(R)2
6.2. Взаимодействие малоновой кислоты с карбонильными соединениями (Э. Кневенагель, 1896 г.):

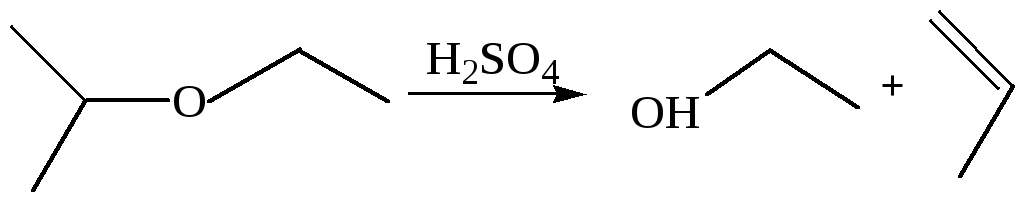
7. Деалкоголиз простых эфиров. Отщепление спирта в простых эфирах осуществляется действием сильных кислот, связывающих спирт:
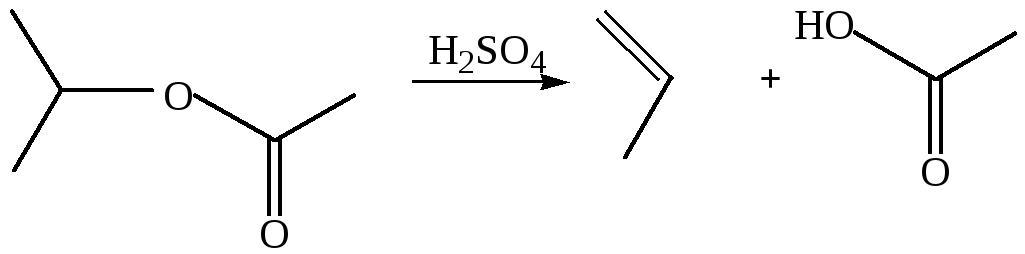
8. Из сложных эфиров. Образование алкенов идет по типу ЕN1:
9. Деаммонолиз. Связь в аминах С–N менее полярна по сравнению C–O в спиртах, гомолитический разрыв возможен в результате пиролиза при высоких температурах:
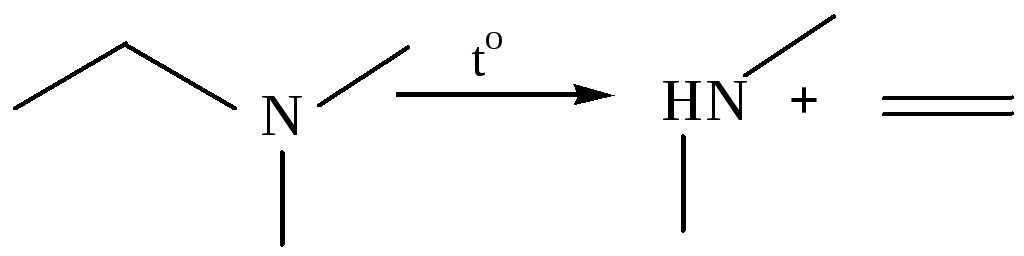
Физические свойства и строение алкенов. Первые представители гомологического ряда алкенов (С2 – С4) при обычных температурах – газы, следующие члены ряда – бесцветные жидкости или кристаллические вещества. Этилен и пропен имеют слабый запах. При увеличении числа углеродных атомов и разветвлении цепи запах становится едким.
Алкены имеют более низкие температуры плавления и кипения по сравнению, например, со спиртами с аналогичной молекулярной массой, т. к. единственными силами притяжения между неполярными углеводородными фрагментами молекул алкенов являются слабые ван-дер-ваальсовы силы. В гомологическом ряду алкенов температуры кипения закономерно возрастают. Алкены с разветвленной углеродной цепью имеют более низкие температуры кипения, чем изомеры с нормальной цепью. Низшие гомологи этилена образуют более плотно упакованные молекулярные кристаллические решетки из-за плоского строения участка ионной связи, что объясняет их более высокую относительную плотность по сравнению с соответствующими алканами. Чем выше молекулярная масса, тем меньше это различие.
Таблица 20 – Физические свойства некоторых алкенов
|
Соединение |
|
Формула |
Температура, °С |
Плотность,
| |
|
плавления |
кипения | ||||
|
этен |
28 |
СН2=СН2 |
–169 |
|
0,5699* |
|
пропен |
40 |
СН3СН=СН2 |
–185 |
–47,4 |
0,5193* |
|
бутен-1 |
52 |
СН3СН2СН=СН2 |
–130 |
–6,3 |
0,5951* |
|
цис-бутен-2 |
52 |
СН3СН=СНСН3 |
–139 |
3,7 |
0,6213 |
|
транс-бутен-2 |
52 |
СН3СН=СНСН3 |
–105 |
0,9 |
0,6042 |
|
2-метилпропен-1 |
52 |
СН3С(СН3)=СН2 |
–140 |
–6,9 |
0,5942* |
|
пентен-1 |
64 |
СН3(СН2)2СН=СН2 |
–138 |
30,0 |
0,6405 |
|
цис-пентен-2 |
64 |
СН3СН2СН=СНСН3 |
–151 |
36,9 |
0,6556 |
|
транс-пентен-2 |
64 |
СН3СН2СН=СНСН3 |
–136 |
36,4 |
0,6482 |
|
2-метилбутен-2 |
64 |
СН3С(СН3)=СНСН3 |
–123 |
38,6 |
0,6623 |
|
октадецен-1 |
252 |
СН3(СН2)15СН=СН2 |
+17,6 |
+314,8 |
0,7890 |
Примечание: * значения измерены при температуре кипения
Алкены хорошо растворяются в бензоле, тетрахлорметане, петролейном и диэтиловом эфирах, но практически не растворяются в воде.
Наличие π-связи объясняет такие свойства алкенов, как повышенная рефракция, пониженная энергия одной связи, легкая поляризуемость. Электроны π-орбитали находятся дальше от атомных ядер, поэтому они более подвижны, энергия π-орбиталей меньше, чем энергия σ-орбиталей. Отрыв электрона от π-орбитали требует затраты меньшего количества энергии, чем отрыв электрона от σ-орбитали. Плотность, коэффициент преломления и молекулярная рефракция алкенов выше по сравнению с алканами с тем же числом углеродных атомов, что свидетельствует о большей поляризуемости двойной связи (табл. 20). Физические параметры двойной связи приведены в таблице 21.
Таблица 21 – Сравнительные физические параметры связей углеводородов
|
Связь |
Длина, нм |
Средняя энергия, кДж/моль |
Рефракция связи, RD, см3 |
Тип атома углерода |
Дипольный момент, μ, D |
|
С=С |
0,133 |
615 |
4,170 |
sp2 |
0,68 |
|
С–С |
0,154 |
344 |
1,296 |
sp3 |
0,40 |
|
С≡С |
0,120 |
838 |
6,240 |
sp |
1,0 |
Особого внимания заслуживает сравнение термодинамической устойчивости изомерных алкенов. Введение алкильных групп у двойной связи термодинамически стабилизирует молекулу алкена. Это следует из значений стандартной энтальпии (теплот) сгорания алкенов и теплот гидрирования. Чем меньше теплота сгорания соединений одинакового состава, тем стабильнее соединение. Аналогично уменьшаются теплоты гидрирования.
Химические свойства. Характеристика реакционной способности. Реакции непредельных углеводородов обусловлены наличием в их составе кратной связи.
π-cвязь менее прочная, чем σ, по месту ее разрыва возможно присоединение к углеродным атомам. Поскольку π-электроны обладают большей подвижностью, то для π-связи предпочтителен гетеролитический разрыв.
π-электроны находятся на периферии молекулы, более доступны, чем ядро атома углерода, поэтому в реакции присоединения алкены выступают как доноры электронов или основания Льюиса. Следовательно, алкены могут взаимодействовать с электрофильными и нейтральными частицами, оставаясь инертными к нуклеофильным реагентам. Таким образом, для алкенов более характерны реакции электрофильного присоединения (АЕ);
поскольку в молекулах алкенов связи неполярны или малополярны возможен их гомолиз, и соответственно, могут протекать реакции АR и SR по углеводородному радикалу. Связь С=С может стабилизировать соседний радикальный центр за счет делокализации электронов и таким образом способствовать SR реакции по этому центру молекулы;
за счет разрыва π-связей непредельные углеводороды склонны к реакциям полимеризации, которые можно отнести к особому типу присоединения;
благодаря наличию π-связей алкены легко вступают в реакции окисления.
Реакции присоединения.
В общем виде механизм реакции АЕ можно показать на следующей схеме:

Стадия электрофильной атаки. Электрофил образует с кратной связью молекулярный комплекс (π-комплекс), в котором осуществляется пространственная ориентация реагирующих веществ. Затем происходит гетеролитический разрыв π-связи, т. е. электрофил образует новую σ-связь с атомом углерода, а соседний С–атом приобретает «+» заряд и возникает карбокатион.
Стадия нуклеофильной атаки. Образовавшийся карбкатион активен и взаимодействует с любым нуклеофилом, имеющимся в реакционной зоне.
Для несимметричных алкенов в реакциях, протекающих по механизму АЕ присоединение происходит по правилу В.В. Марковникова: при присоединении протонных кислот и воды водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. Или в современной трактовке: присоединение протона к алкену осуществляется в направлении образования наиболее стабильного карбокатиона.
Устойчивость карбокатиона зависит от строения и падает в ряду:
третичный > вторичный > первичный
Алкильные группы обладают большими электронодонорными свойствами, чем водород, и могут принимать участие в частичной компенсации положительного заряда на атоме углерода карбкатиона вследствие действия положительного индукционного и мезомерного эффектов (σ, р). Следовательно, чем больше алкильных групп связано с С+, тем больше они будут компенсировать заряд и тем более устойчивым окажется комплекс.
Известно много исключений из правила В.В. Марковникова в его классической интерпретации. Но, хотя формально, эти реакции протекают против правила, они соответствуют его обобщенной форме: присоединение осуществляется с образованием наиболее устойчивой промежуточной частицы. Причиной протекания реакции против правила В.В. Марковникова может служить механизм реакции. Так, реакции протекающие по АR, образуют аномальный продукт (реакция Караша):
2H–Br
+ •O–O•
![]() H2O2
+ 2Br•
H2O2
+ 2Br•
CH3–CH=CH2
+ Br•
![]() CH3–C•H–CH2–Br
CH3–C•H–CH2–Br
CH3–C•H–CH2–Br
+ H–Br
![]() CH3–CH2–CH2–Br
+ Br•
CH3–CH2–CH2–Br
+ Br•
Следует отметить, что из всех галогеноводородов только бромоводород обнаруживает перекисный эффект. Атом хлора более богат энергией и не получается таким путем, а атом йода, как малореакционноспособный, не может подержать цепь реакции.
1. Гидрирование (катализаторы: Ni, Pt, Pd и др. при комнатной температуре):
![]()
2. Галогенирование (в присутствии полярных растворителей: вода, спирт, уксусная кислота и др.). Реакция является качественной на двойную связь:
Галогенирование в среде полярного растворителя протекает по электрофильному двухстадийному механизму, с позиций которого можно рассмотреть стереохимию галогенирования. На стадии электрофильной атаки неполярная молекула галогена поляризуется под влиянием полярного растворителя либо под влиянием электрического поля кратной связи, после чего образуется с молекулой углеводорода π-аддукт:
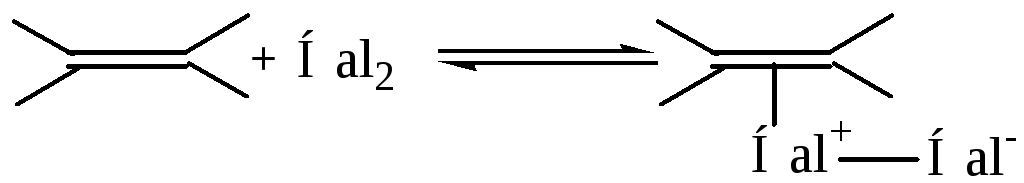
Затем связи С=С и Hal–Hal гетеролитически разрываются, электрофил Hal+ вытягивает пару π-электронов и образует за ее счет σ-связь с атомом углерода. Возникает карбокатион, который может образовать циклический галогеоний-катион.
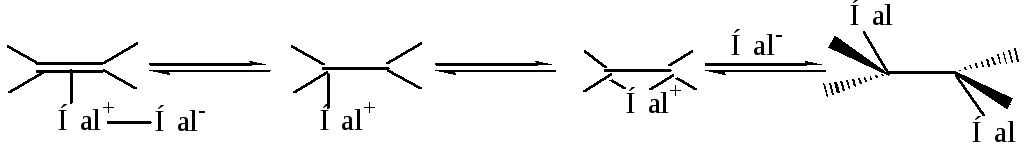
Таким образом, реакция галогенирования протекает как транс–присоединение, подтверждая стереоселективность реакции.
3. Реакции с Н–электрофилами (Н–Х, где Х – анион кислоты):
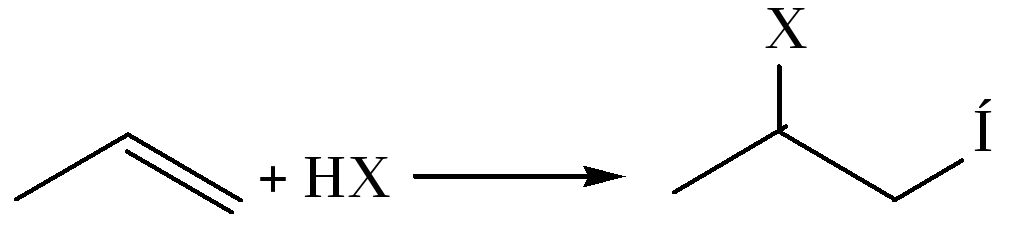
При взаимодействии с серной кислотой в реакции образуются алкилсульфаты, которые при нагревании с водой подвергаются гидролизу с образованием спирта (Х – SO4H -):
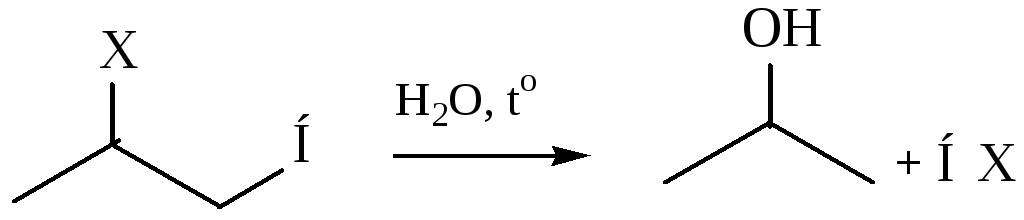
4. Присоединение гипогалоидных кислот, образуются галогенгидрины:
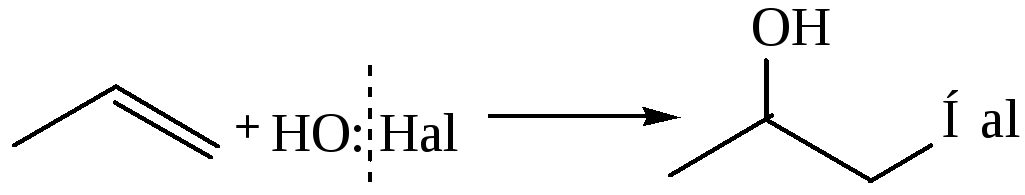
Такие же продукты можно получить при хлорировании алкена в водном растворе (сопряженное присоедиение).
5. Присоединение С-электрофилов к алкенам:
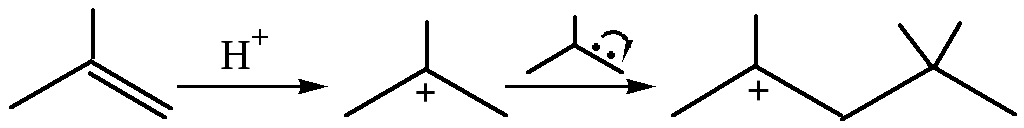
Если в реакционной смеси присутствуют какие-либо другие вещества, димерный катион может отдать протон, превращаясь при этом в два алкена:
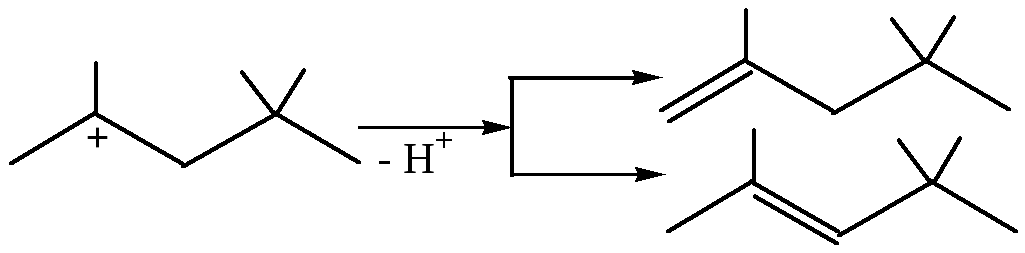
Такой процесс называют димеризацией алкенов.
6. Карбонилирование (гидроформилирование или оксосинтез, катализатор – НСо(СО)4):
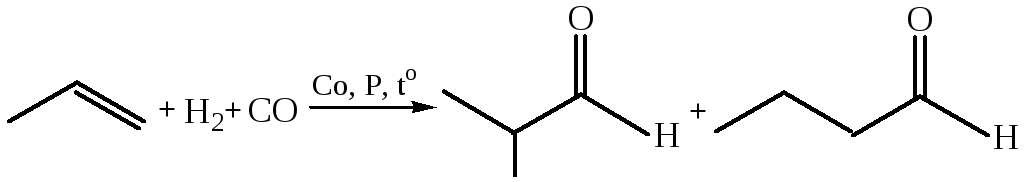
Если реакцию проводить с последующей обработкой продуктов реакции нуклеофильными реагентами продуктом будут карбоновые кислоты и их производные:

7. Радикальные реакции. Реакции такого типа у непредельных углеводородов могут протекать с участием кратных связей (AR) и С–Н связей (SR).
7.1 Реакции радикального присоединения. В качестве примера АR – реакции можно рассмотреть реакцию Караша. Подобные реакции не характерны для алкенов, но могут протекать при особых условиях (температура, УФ-свет, пероксиды).
Алкены присоединяют свободные радикалы по π-связи с образованием нового свободного алкильного радикала, при этом могут происходить рекомбинаци радикалов, отрыв водородного атома от других молекул. При этом начинается процесс олигомеризации и полимеризации, возможно диспропорционирование алкильного радикала:

7.2 Реакции радикального замещения. Замещение осуществляется у атома углерода, который находится рядом с двойной связью (аллильное положение):
7.2.1 Аутоокисление:
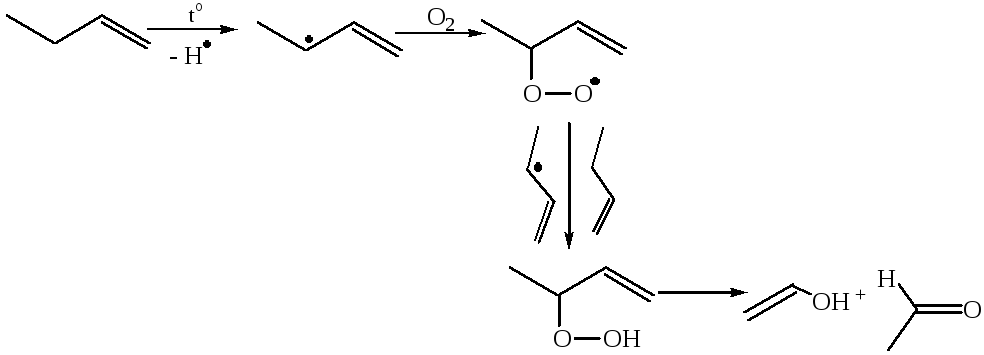
Процесс образования аллильных радикалов может быть конкурирующим присоединению по двойной связи.
7.2.2 Изомеризация (выше 500оС):
![]()
7.2.3 Аллильное галогенирование:
![]()
Аллильные радикалы являются более стабильными, чем обычные алкильные радикалы, что обусловлено сопряжением неспаренного электрона с двойной связью.
