
- •2. Основные принципы – стадии подхода к выбору и дизайну прекурсоров – мос с молекулярным строением.
- •3. Типы прекурсоров, примеры реакций синтеза наноматериалов.
- •4. Пути синтеза прекурсоров с заданной – равной летучестью.
- •5. Методы оценки стерических затруднений и межмолекулярных контактов
- •3. Химические транспортные реакции. Установка с движением газа при конвекции. Примеры реакций.
- •4. Химические транспортные реакции. Параметры, влияющие на протекание процесса. Примеры реакций.
- •2.Стадии cvd процесса. Влияние газовой фазы на протекание процесса.
- •3.Преимущества метода. Классификация методов cvd.
- •4.Недостатки метода cvd. Функциональные элементы cvd установок.
- •5.Область применения метода cvd. Сvd реактор для непрерывного синтеза многослойных материалов.
- •6.Механизмы роста вискеров из газовой фазы. Примеры синтеза вискеров металлов.
- •7.Cvi процесс (Основы метода, область применения и схема установки)
4. Пути синтеза прекурсоров с заданной – равной летучестью.
Для координационно насыщенных соединений определяются:
Термохимические данные для органических соединений
Данные о строении или результаты моделирования геометрии прекурсоров
После чего осуществляется синтез веществ-прекурсоров с заданными свойствами –летучестью
5. Методы оценки стерических затруднений и межмолекулярных контактов
Экранирование центрального атома и методы его количественной оценки
• Изучение стерических факторов, а также разработка подходов к эмпирическим и качественным объяснениям пространственного экранирования центрального атома (ц.а.) позволяет посредством определения степени экранирования ц.а., расчета числа и определения типов ММК получить достаточно надежную информацию о термохимических свойствах соединения, не прибегая к их непосредственному экспериментальному исследованию. В случае, когда прямое экспериментальное определение данных параметров невозможно – это приобретает первостепенное значение.
• К настоящему времени, сформировались и активно развиваются ряд полуэмпирических подходов к описанию и определению экранирования центрального атома, числа и типов межмолекулярных контактов, опирающиеся на принцип аддитивности – это методы «телесных углов», «расширяющийся координационной сферы», «полиэдров Воронова-Дирихле» и некоторые другие.
Метод «Телесных углов»
• С.А.Толман попытался количественно охарактеризовать стерические факторы, используя понятие о телесном угле, описывая фосфиновые лиганды, и связал физические, химические и каталитические свойства этих комплексов. По А.Бонди молекулярный кристалл получается, когда закрыто более 80 % координационной сферы металла. Далее исследователи для количественной оценки степени пространственного экранирования центрального атома использовали телесные углы с вершиной на атоме металла, заполняемые заместителями. Атомы представляются в виде жестких шаров с соответствующими Ван-дер-Ваальсовыми радиусами.
Общая идея расчета телесных углов заместителей и цилиндрических проекций молекул состоит в построении проекции молекулы в сферической ицилиндрической системах координат соответственно на сферу и цилиндр единичного радиуса.
Недостаток – метод недостаточно учитывает степень заполнения координационной сферы экранирующими атомами лигандов отдельно.
Метод «Расширяющейся координационной сферы»
Более перспективным подходом является представление степени заполнения координационной сферы у ц.а. в виде отношения части площади сферы (с центром, совпадающим с ц.а.), пересекающей лиганд, к общей площади данной сферы в зависимости от ее радиуса R (рис. ниже). В этом случае по графику определяется "критическое сечение" лиганда Рmax. Сумма Pмах не может быть более 100%.
В методе «случайных столкновений», реализованном в компьютерной программе «КОНТАКТ», рассматриваются случайные столкновения идентичных молекул соединения. Каждая молекула, при фиксированном положении второй, три раза поворачивается на произвольные углы относительно трех осей
координат, после чего рассчитывают минимальное расстояние между атомами противоположных молекул, которое заносится в память компьютера. После большого числа таких циклов вращения рассчитывается вероятность осуществления контакта того или иного атома молекулы. Атомы, у которых значение данной вероятности отлично от «0», считаются участвующими в межмолекулярном взаимодействии. Далее
осуществляется разбиение атомов лигандов на функциональные группы и расчет энтальпии парообразования методом аддитивных вкладов. Атомы двух молекул считаются контактирующими, если расстояние между ними меньше суммы их радиусов Ван-дер-Ваальса. Таким образом, очевидно, что при сближении двух идентичных молекул наиболее вероятным будет контакт между атомами с наименьшем расстоянием между ними.
Метод полиэдров «Воронова-Дирихле» позволяет находить межмолекулярные контакты, не привлекая дополнительных данных, в том числе значений радиусов Ван-дер-Ваальса.
• Молекулярный полиэдр Воронова-Дирихле (ПВД) представляет собой область пространства, ограниченную набором пересекающихся плоскостей, каждая из которых перпендикулярна отрезку, соединяющему атом рассматриваемой молекулы с каким-либо атомом одной из молекул окружения, и делит этот отрезок в отношении, зависящем от природы контактирующих атомов. Для атомов одинакового сорта (например, атомы водорода) коэффициент деления равен 0.5. Каждая грань молекулярного ПВД отвечает контакту между атомами соседних молекул. Граничная поверхность, формируемая гранями ПВД атомов, отвечающих контактам между атомами двух соседних молекул, соответствует контакту молекула-молекула
ЛЕКЦИЯ 2
Сравнительная оценка экранирующей способности основных типов лигандов.
Классы: 1.алкилы
2.ферроцены и алкилферроцены
3.β-дикетонаты металлов
4.алкоксиды
5.галогениды, алкиламиды и другие соединения со связью металл-элемент
Классификация атомов при расчетах энергетики молекул обычно проводится по атомам или по связям. В рассматриваемом варианте структурный элемент - центральный атом, для которого учитывается "первое окружение" - совокупность непосредственно связанных с ним атомов другого вида. Если взять связывающую часть составляющей энергии межмолекулярного взаимодействия U (по Лондону) можно показать, что для пары атомов составляющая энергии дисперсионного взаимодействия практически незначима. Это, в общем, проистекает и из понятия радиуса Ван-дер-Ваальса как радиуса сферы, ограничивающей область связывания данного атома с другим атомом.
"Первое окружение" таким образом экранирует ц.а., нивелирует его физико- химическую индивидуальность с точки зрения ММВ. Однако опосредованное влияние ц.а. может и должно проявляться на ММВ через "первое окружение". Это влияние должно быть более ярко выражено в гомолептических ионных галогенидах, в меньшей степени в случае образования дополнительных связей атомами "первого окружения" ц.а..
Таким образом, учитывая современный уровень экспериментальной техники определения энтальпий испарения и сублимации, можно полагать, что в случае достаточного экранирования ц.а., его влияние может, в принципе, проявляться в ММВ первого окружения ц.а. и несущественно при экранировании данного первого окружения от участия в ММВ.
Несмотря на множественность требований, им в той или иной степени удовлетворяют соединения нескольких классов. Используемые прекурсоры зачастую довольно специфичны для разных классов осаждаемых материалов. Так, например, для нанесения металлических покрытий лучше всего подходят карбонилы металлов или их галогениды, в отдельных случаях металлорганические соединения – МОС. Для осаждения полупроводников используются галогениды, гидриды или МОС. Для выращивания оксидных пленок наиболее часто используют бета-дикетонаты металлов, иногда алкоголяты.
Парообразование бета-дикетонатов металлов. Лантаноиды. Примеры использования для синтеза наноматериалов.
3
|
|
CH3 CH CH3 H3C
H3C CH3
O O
|
Повышенная подвижность атома водорода при альфа-атоме углерода, находящемся между двумя карбонильными группами, обуславливает способность b – дикетонов к кето-енольной перегруппировке.
В
растворе
дикетона
(или
в самом жидком дикетоне)
устанавливается
равновесие
между
обеими
формами,
характеризуемое
константой
кето-енольного
равновесия.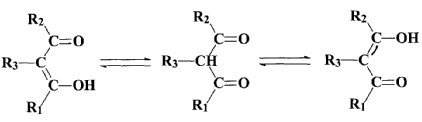
В присутствии сильного основания может происходить реакция нейтрализации с образованием соли щелочного металла и воды, например, HL + NaOH =NaL + H2O .
Летучесть b – дикетонатов. При обычных условиях b – дикетонаты металлов - кристаллические вещества с молекулярной структурой, т.е. в узлах их кристаллической решетки располагаются молекулы.В этих молекулах прочные ионные взаимодействия между катионом металла и анионом экранированы со всех сторон углеводородными остатками лигандов. Поэтому взаимодействия между соседними молекулами в кристалле являются ван-дер-ваальсовыми, т.е. слабыми. При нагреве межмолекулярные связи легко разрушаются и вещество испаряется. Именно характером межмолекулярных связей и экранировкой внутримолекулярных ионных взаимодействий обусловлена высокая летучесть b – дикетонатов. Очевидно, что наличие в молекуле лиганда разветвленных боковых заместителей повышает летучесть соединений.
В то же время использование более длинного, но неразветвленного заместителя, несколько повышает межмолекулярное взаимодействие, и, соответственно, понижает летучесть таких соединений.
Наибольшей летучесть обладают координационно насыщенные соединения, не склонные к образованию олигомеров или водородных связей в конденсированной фазе.
Особенности парообразования алкоксидов. Примеры использования для синтеза наноматериалов.
Алкоголяты многих металлов проявляют свойство летучести при пониженном давлении, что позволяет использовать их для получения оксидных пленок из паровой фазы. Это особенно важно для тех металлов, бета-дикетонаты которых труднодоступны: Ti, Nb, Та, Мо, W. Известны также летучие алкоголяты и оксо-алкоголяты элементов III группы,
включая РЗЭ. возгоняется на Например, оксо-изопропилат иттрия 60% при 180°С и давлении 10 торр, Y5O(O-iC3H7)13 т.е. он, хотя и является летучим, но не переходит в пар полностью.
Особенности парообразования циклопентадиенильных координационных соединений – прекурсоров. Примеры использования для синтеза наноматериалов.
К МОС относятся алкилы металлов и летучие циклопентадиенильные соединения с сэндвичевой структурой, например, ферроцен. Ферроцен устойчив на воздухе, в то же время известные соединения этого класса для РЗЭ, ЩЗЭ и переходных металлов исключительно чувствительны к окислению и большинство из них способно самовоспламеняться на воздухе. Описан комплекс бис-(пентаметилциклопентадиенил) барий, способный к препаративной сублимации при давлении 10 Па и температуре 160°С. Трис-циклопентадиенильные соединения РЗЭ отличаются такой же высокой чувствительностью к окислению и могут быть сублимированы при 200°С и давлении 10 торр.
Галогениды, гидриды. Примеры использования для синтеза наноматериалов.
Одним из наиболее важных промышленных процессов является осаждение высокочистого кремния по реакции SiCl4 + 2H2 = Si + 4HCl .
Интересный пример CVD-выращивания пленок висмутсодержащих сверхпроводников был реализован с применением летучих галогенидов — BiCl3, CuI, CaI2, SrI2 , нагреваемых в потоке инертного газа-носителя:
2 BiCl3 + 2 CaI2 + SrI2 + 2 CuI + 9 H2O = Bi2Ca2SrCu2O9 + 8 HI + 6 HCl + 2 H2.
ЛЕКЦИЯ 3
Химические транспортные реакции. Принцип метода. Примеры
Хим.трансп.реакции – обратимые хим.реакции, в которых твердый или жидкий компоненты взаимодействует с одним или нескольким газообразным компонентом, образуя 1 или несколько газообразных веществ. Метод транспортных реакций применяется для получения различных чистых веществ как простых, так и сложных. В качестве транспортирующего агента часто используют галогены, галогеноводороды, водяной пар, кислород, водород и др. Достоинством транспортных реакций является возможность проведения всех операций в стерильных условиях, поскольку эти реакции проходят в замкнутом объеме и без больших количеств реагентов.
Метод основан на использовании обратимых гетерогенных реакций, в результате которых вещество переносится из зоны растворения в зону роста. В зоне растворения газообразное вещество В реагирует с подлежащим переносу твердым веществом А, образуя газообразный продукт АВ, который посредством диффузии, конвекции или с газовым потоком переносится в зону кристаллизации, где в результате изменения температуры равновесие реакции смещается влево и на затравке кристаллизуется выделяющееся из газовой фазы вещество А.
iA(т,ж) + kB(г) + … = jC(г) + … (1) 1850 – 1890 гг.
Fe2O3(т) + 6HCl(г) = 2FeCl3(г) + 3H2O(г) (2)
2Al(т) + AlCl3(г) = 3AlCl(г) (3)
2. Химические
транспортные реакции. Использование
установки для транспорта твердого
вещества методом потока при градиенте
температуры. Преимущества метода.

![]()
В простейшем случае, если гетерогенная реакция протекает быстро, можно применить, например, трубку диаметром 10 мм, поместив в нее лодочку с первичной фазой А. Но гораздо лучше внести в трубку гранулированное вещество так, чтобы, заполнив ее по всему сечению, оно размещалось рыхлым слоем по длине трубки на несколько сантиметров. Газ-носитель В проходит над первичной твердой фазой А и в идеальном случае полностью вступает с ней в равновесие. В другой зоне трубки, уже при иной температуре, происходит обратная реакция с выделением вещества А (вторичной твердой фазы).
Рост кристаллов данного вещества происходит при температурах значительно более низких, чем в случае кристаллизации из расплава.
получать кристаллы с весьма малой плотностью дислокаций.
можно успешно регулировать стехиометрический состав кристаллизуемого вещества.
Позволяют точно контролировать толщину тонких пленок


