
зачет
.docб1.Предмет и задачи химии. Химия – наука о превращении в-в. Она изучает состав и строение в-в, зависимости св-в в-в от их состава и строения, условия и пути превращения одних в-в в другие. Движение – свойство материи, присущее материи в целом и каждой ее частице. Химия изучает в-во, которое обладает определенными свойствами и своей формулой- химическими реакциями – вещ-во является предметом химии. Все жизненные процессы – изменение движения ( формы). Формы движения – нагревание и охлаждение тел, излучение света, эл. Ток. Одни формы могут переходить в другие. Важная задача – получение заранее предусмотренного в-ва, получение энергии хим. Превращений. В медицине – понимание хим.процессов , лежащих в основе болезни помогает направленному поиску способов ее лечения. Создают препараты, синтезируют в-ва. Препараты обладающие антимикробным. Противовоспалительным, противоожоговые и др. Искуств. органы, сосуды, суставы. Различные химические анализы. Термодинамика-наука о взаимопревращении теплоты и энергии. Термодинамика определяет возможно ли протекание р-ции, в каком направлении. Термодинамич. Система – любой объект природы, состоящий из достаточно большого числа молекул(структурных единиц) и отделенный от других объектов природы реальной или воображаемой границей. Объекты природы не входящие в систему называются средой. Изолированная сист. – не обменивается с окружающей средой ни в-вом, ни энергией ∆м= 0, ∆Е=0.Закрытая сист. - не обменивается в-вом и энергией ∆м=0, ∆Е≠0. Открытая система- обменивается и в-вом и энергией ∆м≠0,∆Е≠0. Обмен энергией может осуществляться передачей теплоты или совершением работы. Гомогенная система- однородная структура (плазма). Гетерогенная – сост. Из 2 гомогенных (кровь).
Свойства
растворов ВМС.
Системы термодинамически устойчивые,
не имеют четко выраженной поверхности
раздела с растворителем. Устойчивость
растворов в большей степени связана с
наличием сольватной оболочки. Вязкость
мера сопротивления среды движению.эту
величину характеризуют коэффициентом
вязкости ŋ. Вязкость растворов значительна
и резко возрастает с увеличением
концентрации. Набухание наз.процесс
проникновения растворителя в полимерное
в-во,сопровождаемое увеличением обьема
и массой образца. Количественно набухание
измеряется степенью набухания![]() .
Сухое вещество набухает и может переходить
в растворенное состояние. Значительная
часть водной оболочки удерживается за
счет полярных групп соприкасается в
изоэлектрической точке. Значение Рн,
при котором белок находится в
изоэлектрическом состоянии. Т.е. в
состоянии, при котором число разноименных
зарядов в белковой частицы одинаково
и ее общий заряд равен нулю, называется
изоэлектрической точкой данного белка.
.
Сухое вещество набухает и может переходить
в растворенное состояние. Значительная
часть водной оболочки удерживается за
счет полярных групп соприкасается в
изоэлектрической точке. Значение Рн,
при котором белок находится в
изоэлектрическом состоянии. Т.е. в
состоянии, при котором число разноименных
зарядов в белковой частицы одинаково
и ее общий заряд равен нулю, называется
изоэлектрической точкой данного белка.
Б2.Первое начало термодинамики – приращение внутренней энергии системы ∆Е в некотором процессе = Q (теплоте) , полученной системы плюс работа W, совершенная над системой в этом процессе. Внутренняя энергия – функция состояния, приращение которой равно теплоте Qv, полученной системой в изохорном процессе (V = const) . Процессы протекающие при (p=const) – изобарные. При (t= const) – изотермические. Система равновесная – если все св-ва остаются постоянными в течении времени ( нет потоков в-ва и энергии. Если свойства постоянны но есть потоки то система стационарная. Энтальпия – функция состояния, приращение которой равно теплоте, полученной системой в изобарном процессе (p=const) энтальпия- H=E+ pV . Математическое выражение 1 го закона ТД. - ∆U=Q-A . Более удобная запись Q=∆U-A.
Получение и свойства дисперсных систем. Для получения коллоидных растворов необходимо: 1) достичь коллоидной степени дисперсности; 2) подобрать дисперсионную среду, в которой нерастворимо в-во, дисперсионной фазы; 3) подобрать третий компонент – стабилизатор сообщающий коллоидной системе устойчивость. Образовать коллоидные растворы в воде могут металлы, малорастворимые в ней оксиды, гидроксиды, кислота, соли. В качестве стабилизатора используют вещества, препятствующие агрегации коллоидных частиц в более крупные и выпадение их в осадок. По способу достижения коллоидной степени дисперсности различают методы : диспергационные – получение частиц дисперсионной фазы путем дробления более крупных частиц, и конденсационные – получение частиц дисперсной фазы путем объединения атомов, молекул, ионов.
Б3.Закон Гесса: Если при постоянной V или P из одинаковых исходных в-в можно получить конечное в-во различными путями, то тепловой эффект не зависит от способа проведения процесса. С6Н12О6+6О2 →6СО2+6Н2О (∆Н=2810 кдж/моль) (1) С(т) +1/2 О2→СО(г) +110 кдж/моль. (2) СО (г)+ 1/2 О2→СО2(г) + 238 кдж/моль. (3) С (т) + О2 → СО2(г) +393кдж/моль. Свойства: 1)дробные коэф.;2)Q и ∆Н ;3)указ. Агрегатные сотояния;4)можно проводить простые арифметические действия. ∆Н⁰обр. : 1)вещ-во должно образов. Из простых в-в Н2(г)+ ½ О2(г)→Н2О; 2)ведется при Т 25⁰С= 298К;3)расчет ведется на 1 моль в-ва;4)P=1 атм.. 1 Следствие зак. Гесса: 1) тепловой эф. Реакции –сумма теплот образования конечных продуктов минус сумма теплот образ. Исходных ∆Н=∑n∆Н⁰обр.кон.-∑n∆Н⁰обр.исх. (n- число в-ва уч-щего в реакции).2 следствие2) тепловой эф. Реакции = сумма теплот сгорания исходных в-в минус сумма сгорания конечных в-в. ∆Н=∑n∆Н⁰сгор.исх.-∑n∆Н⁰сгор.кон. 3) если из одинаковых исходных получаются хим. Различные агрегатные состояния, то их тепловой эффект будут отличаться на теплоту фазовых переходов; 4) теплоты образования простых в-в = 0 : ∆Н⁰обр(Н2) =0. Термохимические реакции: 6С+6Н2+3О2=С6Н12О6, ∆Н⁰=-1270кдж. С+О2= СО2, ∆Н⁰=-390кдж., Н2+1/2 О2=Н2О, ∆Н⁰= -285 кдж.
Классификация дисперсных систем. По степени дисперсности различают две группы систем: грубодисперс. и коллоидно - дисперсные. Системы со слабым взаимодействием между фазой и средой лиофальными коллоидами (золи). С сильным взаимодействием лиофильными. Таблица- среда –фаза - система(назв): газ газ не сущ; газ жид. туман; газ тв. дым (пыль); жидкость газ пена; жидкость жид. эмульсоид; жидкость тв.тело суспензоид; тв. тело газ пемза; тв. тело жидкость тв. эмульсоид; тв. +тв. сплав.
Б4.Обратимые и необратимые процессы. Процесс называется термодинамически обратимым, если при переходе из начального состояния1 в конечное состояние 2 все промежуточные состояния оказываются равновесными. Процесс называется термодинамически необратимым, если хоть одно из промежуточных состояний неравновесное. Процессы жизнедеятельности можно считать примером необратимых процессов; Т.к. для обратимости необходимо медленное изменение параметров системы- температуры, давления. концентрации в-в, что в живом организме не возможно; растворение сахара в стакане чая -процесс теплообмена при конечной разности температур. Обратимый: (Т=const). При расширении газа Q→ при сжатии Q←
Коллоидные ПАВ. Биолог. Важные кол. ПАВ. Коллоидные ПАВ – вещества, которые с одним и тем же растворителем в зависимости от условий образуют истинный и коллоидный раствор. Процесс образования мицелл в растворах коллоидных ПАВ термодинамически выгоден. Константы между одинаковыми неполярными группами приводят к уменьшению энергии Гиббса приблизительно на 2 кдж\моль по сравнению с константами полярных и неполярных групп. Ядро образовавшихся мицелл составляют неполярные радикалы, а внешнюю обкладку – полярные группы, что обеспечивает наименьший контакт гидрофобных групп с водой. Форма образовавшихся мицелл зависит от концентрации раствора при небольших концентрациях коллоидного ПАВ образуются сферические мицеллы. При более высокой концентрации сферических мицелл образуются цилиндрические и пластинчатые.
Б7.Самопроизвольные процессы. Процесс называется самопроизвольным, сли он осуществляется без каких либо воздействий, когда система предоставлена самой себе. Химические реакции при которых происходит уменьшение энергии Гиббса системы (∆G<0) и совершается работа, называются экзергоническими. Реакции, в результате которых эн. G возрастает ∆G>0 и над системой совершается работа, называются эндергоническими.При ∆G=0 термодин равновесие, ∆G меньше 0 –процесс самопроизвольно протекает в прямом нарпавлении, при ∆G больше 0- прямой процесс самопроизвольно протекать не может, только обратны
Б5.
Второе начало термодинамики:
в изобарно изотермических условиях
(р,Т = const) в сист. Самопроизвольно могут
осуществляться только такие процессы.
В результате которых энергия Гиббса
системы уменьшается (G<0). В состоянии
равновесия энергия гиббса не меняется
(G= констТ,∆G=0). ∆G<0; р,т = конст.. Планк
и Кельвин: 2 закон Т.Д.: невозможно
построить тепловую машину, вся деятельность
которой сводиться к совершению работы
и охлаждению теплового резервуара.
Клаузиус : 2 зак. Т.Д. : самопроизвольный
переход тепла от менее нагретого к более
– невозможно. Теплодатчик(Q1)→раб.А→теплоприемник(Q2).
Вечный двигатель второго порядка
невозможен.![]() .
Клаузиус : S- энтропия (энергия ушедшая
в теплоприемник)- это энергия рассеянная
в системе, является мерой хаотичности
системы, т.е. энергия обесцененная –
невозможная ни во что превращаться
.S=
.
Клаузиус : S- энтропия (энергия ушедшая
в теплоприемник)- это энергия рассеянная
в системе, является мерой хаотичности
системы, т.е. энергия обесцененная –
невозможная ни во что превращаться
.S=![]() (обратим.
Процесс). S>
(обратим.
Процесс). S>![]() Самопроизвольные
процессы протекают самопроизвольно
только с увеличением энтропии→она явл.
Направленностью процесса. ∆S>0 – идет
процесс ∆S=0 – в равновесии. Больцман
связал энтропию с вероятностью(W) - S=k
lnW (k – константа Больцмана, k= R/Na.
Самопроизвольные
процессы протекают самопроизвольно
только с увеличением энтропии→она явл.
Направленностью процесса. ∆S>0 – идет
процесс ∆S=0 – в равновесии. Больцман
связал энтропию с вероятностью(W) - S=k
lnW (k – константа Больцмана, k= R/Na.
Устойчивость
дисперсных систем.
Соединения, коагуляция, порог коагуляции.
Правило Шульц-Гарди. Коагуляция –
слияние или слипание частиц дисперстной
фазы. Факторы коагуляции: свет, температура,
мех. воздействие, действие электронов
– основной фактор. Порог коагуляции –
такая концентрация электронов которая
вызывает явную коагуляцию. ![]() =
. Процесс оседания коллоидных частиц
в растворе называется седиментацией.
Высокодисперсные системы обладают
большой кинетической устойчивостью и,
наоборот, грубодисперсные неустойчивы
,т.к частицы практически не могут
осуществить тепловое движение. Правило
Шульца-Гарди коагулирующим действием
обладает тот ион,который одинаков по
заряду с ионами диффузного слоя.
=
. Процесс оседания коллоидных частиц
в растворе называется седиментацией.
Высокодисперсные системы обладают
большой кинетической устойчивостью и,
наоборот, грубодисперсные неустойчивы
,т.к частицы практически не могут
осуществить тепловое движение. Правило
Шульца-Гарди коагулирующим действием
обладает тот ион,который одинаков по
заряду с ионами диффузного слоя.
Б6.Энергия Гиббса: определяется через энтальпию Н и энтропию S с помощь соотношения : G=Н- ТS ; ∆G=∆Н-Т∆S - такой процесс называется изобарно-изотермическим. Энергия Гиббса реакции = сумма энергий Гиббса образования стехиометрического количества продуктов за вычетом алгебраической суммы энергий Гиббса образования стехиометрического количества реагентов. ∆G= (nс∆Gс+nd∆Gd)-(na∆Ga+nb∆Gb). В состоянии равновесия энергия Гиббса не изменяется (G=конст,∆G=0).
Строение
коллоидной мицеллы.
АgNO₃+KJ(изб)>АgJ⤓+KNO₃
{m[АgJ]·nJ¯·(n-x)К⁺·XK⁺
([АgJ]- агрегат; nJ¯ - потенциал определяющий
ионы; k⁺
-адсорбционный слой противоиона; XK⁺
-диффузионный слой противоиона;
{m[АgJ]·nJ¯·(n-x)К⁺
-гранула). Правило Пенета-Фаянса – на
твердом агрегате адсорбируется тот
ион, который входит уже в его состав.
Свойства КС: прозрачные, фильтруются,
не проходят через пергамент, гетерогенные,
дают конус Тендаля, относительно
устойчивы, со временем стареют. Частицы
различных тканей животных и растительных
организмов обуславливают разнообразие
их свойств. Коллоидные вещества могут
связывать большие количества Н2О, а
также соединятся с самыми разнообразными
веществами. Адсорбция имеет важное
значение при обмене веществ, процессе
пищеварения, и воздействия лекарственных
веществ. Оптические свойства коллоидных
систем. Закон рассеивания света, согласно
которому интенсивность рассеянного
света прямо пропорционально квадрату
объема частиц и обратно пропорционально
четвертой степени длины волны падающего
света. I=I₀K![]() . Окраска золей. Рассеяние света в
коллоидных системах и наблюдающиеся
при этом изменение окраски коллоида
называются опалесценцией. Коллоидные
частицы имеющие диаметр меньше половины
длины световой волны, не могут быть
видимы в обычные микроскоп – создали
утрамикроскопию. Электронный микроскоп
позволяет видеть микробы, фаги, вирусы,
структурные элементы клеток.
. Окраска золей. Рассеяние света в
коллоидных системах и наблюдающиеся
при этом изменение окраски коллоида
называются опалесценцией. Коллоидные
частицы имеющие диаметр меньше половины
длины световой волны, не могут быть
видимы в обычные микроскоп – создали
утрамикроскопию. Электронный микроскоп
позволяет видеть микробы, фаги, вирусы,
структурные элементы клеток.
Б8.Обратимыми
по
направлению химическими реакциями
называются такие реакции, которые при
данных внешних условиях могут
самопроизвольно протекать как в прямом,
так и в обратном направлении. когда
скорости прямой и обратной реакции
становятся одинаковыми наступает
химическое равновесие. Необратимые
реакции протекают до конца -до полного
израсходования одного из реагирующих
в-в, когда скорости прямой и обратной
р-ции становятся одинаковыми, наступает
хим.равновесие. Химическое равновесие
называют динамическим. Эти подчеркивается,
что при равновесии протекают и прямая
и обратная реакции, но их скорости
одинаковы, вследствие чего изменений
в системе не заметно. Количественной
характеристикой химического равновесия
служит величина. Называемая константой
химического равновесия. Рассмотрим ее
на примере реакции синтеза иодоводорода:
Н2+J2↔2НJ согласно зак. Дейст. Масс.
Скорости прямой(v1 ) и обратной (v2 )реакции
выражаются уравнениями v1=k1(Н2)(J2)
v2=k2(НJ)² при равновесии скорости прямой
и обратной реакции равны друг другу :
k1(Н2)(J2) =k2(НJ)² или ![]() отношение констант скорости прямой и
обратной реакции представляет собой
константу. Она называется константой
равновесия данной реакции (К): отсюда
окончательно :
отношение констант скорости прямой и
обратной реакции представляет собой
константу. Она называется константой
равновесия данной реакции (К): отсюда
окончательно : ![]() .
Закон действующих масс (гульдберг и
вааге) :при постоянной температуре
скорость химической реакции пропорциональна
произведению концентраций реагирующих
веществ, причем каждая концентрация
входит в произведение степени, равной
коэффициенту ,стоящему перед формулой
данного вещества в уравнении реакции.
В общем виде для уравнения aA+bB+…=…
тогда З.Д.М. можно записать v=
.
Закон действующих масс (гульдберг и
вааге) :при постоянной температуре
скорость химической реакции пропорциональна
произведению концентраций реагирующих
веществ, причем каждая концентрация
входит в произведение степени, равной
коэффициенту ,стоящему перед формулой
данного вещества в уравнении реакции.
В общем виде для уравнения aA+bB+…=…
тогда З.Д.М. можно записать v=![]() …
В случае гетерогенных реакций в уравнение
здм входит концентрации только тех в-в
,которые находятся в газовой фазе или
в растворе. Концентрация твердого в- ва
представляет собой постоянную величину
и поэтому входит в константу скорости.
например для горения угля: С=О2=СО2 здм
запишется так : U=k’∙ конст ∙ (О2)= k(О2)
где k=k’∙конст.
…
В случае гетерогенных реакций в уравнение
здм входит концентрации только тех в-в
,которые находятся в газовой фазе или
в растворе. Концентрация твердого в- ва
представляет собой постоянную величину
и поэтому входит в константу скорости.
например для горения угля: С=О2=СО2 здм
запишется так : U=k’∙ конст ∙ (О2)= k(О2)
где k=k’∙конст.
Адсорбция газов на твердых телах. Отличия : У жидкости поверхность однородна, а у твердых тел неоднородна. Уравнение Ленгмюра(a=) является одной из форм уравнения изотермы адсорбции. Уравнение Фрейдлиха (а=кфсн кф-константа численно равная адсорбции при равновесной концентрации=1; н-константаопределяющая кривизну изотермы адсорбции.) Под уравнением изотермы адсорбции ( чаще говорят – изотерма адсорбции) понимают зависимость равновесной величины адсорбции от концентрации адсорбтива а=f(С) при при постоянной температуре. Концентрация адсорбтива для случая адсорбции жидкости выражается , как правило, в мольных либо в массовых долях.Часто, особенно в случае адсорбции из растворов, пользуются относительной величиной: С\Сs, где С концентрация, Сs – предельная концентрация (конц. Насыщения) адсорбтива при данной температуре. В случае адсорбции из газовой фазы концентрация может быть выражена в единицах абсолютного давления, либо, что особенно типично для адсорбции паров, в относительных единицах: Р\Рs, где Рдавление пара, Рs – давление насыщенных паров этого вещества. Саму величину адсорбции можно выразить также в единицах концентрации ( отношение числа молекул адсорбата к общему числу молекул на граниче раздела фаз). Для адсорбции на твердых адсорбентах, особенно при рассмотрении практических задач, используют отношение массы или количества поглощенного вещества к массе адсорбента, например мг\г или моль\г. В изотерме наблюдаетя точное совпадение расчета данных только в области среднего значения концентрации. Высокое и низкое С-отклонение. Адсорбция газов и паров на поверхности твердых тел также происходит в результате уменьшения свободной поверхностной энергии. Ввиду трудности измерения поверхностного натяжения твердых тел, об абсорции на них судят, непосредственно определяя количество адсорбированного вещества. Последнее тем больше. Чем больше поверхность адсорбента. Поэтому для осуществления адсорбционных процессов весьма важно создание высокопористых адсорбентов с развитой внутренней поверхностью, т.е. поверхнотью, приходящейся на 1 г сорбента. Важнейшим пористым сорбентом является активный уголь и силикагель. Ленгмюр в своем уравнении выводил предпосылки: 1) на поверхности твердого адсорбента имеется какое то определенное конечное количество активных центров 2) на каждом центре можно менять только одну молекулу 3) молекулы, находящиеся в неактивных центрах, между собой не взаимодействуют 4) время удержания молекулы на активном центре - невечно.
Б9.Теорема
Пригожина. Применяемость основных
закономерностей ТД к живым организмам.
Организмы как открытые системы. Живые
орг. Находятся в состоянии не равновесном,
т.к. для них равновесие – это смерть. В
живых организмах все процессы идут
только в прямом направлении, с постоянно
скоростью. В организме реакции начин-ся
с 1 го порядка, а заканчиваются 0 порядком.
Свойства живых организмов: 1) Организмы
постоянно удаляются от состояния
равновесия; 2)структура системы находиться
в взаимодействии с окружающей средой.
1945г Пригожин получил нобелевскую. Он
предложил : 1) рассматривать организмы
и окружающую среду как часть одной
системы и все расчеты вести совместно
– одновременно; 2) для живого организма
характерно «стационарное состояние»
все реакции нулевого порядка, т.е.
протекают с одинаковой скоростью только
в прямом направлении; 3) «потки» ввел
(термин); ( организмы способны понижать
свою энтропию); 4) элементы кинетики:
∆S=∆iS (интро внутр) +∆eS(экстра внешняя)
∆S↗;↙∆iS;↗∆eS
∆H=-2816кдж/моль,∆G=-2860; ∆G=∆H-T∆S→∆S=![]() ∆t=∆t(производство энтропии)+ ∆t
(скорость потока) . Теорема Пригожина :
в стационарном состоянии все производные
энтропии стремятся к минимуму.
∆t=∆t(производство энтропии)+ ∆t
(скорость потока) . Теорема Пригожина :
в стационарном состоянии все производные
энтропии стремятся к минимуму.
Хемосорбция – химическая реакция, поглощение одного вещества другим.(адсорбат вступает в химическую связь с адсорбентом). Адсорбция – изотермический процесс. При физической адсорбции выделяется энергия от 4 до 40. Адсорбция жидкости имеет свои особенности: на некотором активном центре адсорбируется сам растворитель, но могут адсорбироваться и ионы. Адсорбцию в случае . когда требуется подчеркнуть природу сил взаимодействия, называют физической адсорбцией.
Б10.Тепловой
эфф. Реакции нейтр.Тепловой
эффект реакции зависит только от
начального и конечного состояния в-в,
и не зависит от промежуточных стадий
процесса. Тепловой эф. Хим. Реакции =
∑теплот образования получающихся в-в
за вычетом ∑теплот образования исходных
в-в. Реакциями нейтрализации называются
обменные реакции взаимодействия кислот
и оснований, в результате которых
образуется соль о вода и выделяется
тнплота.
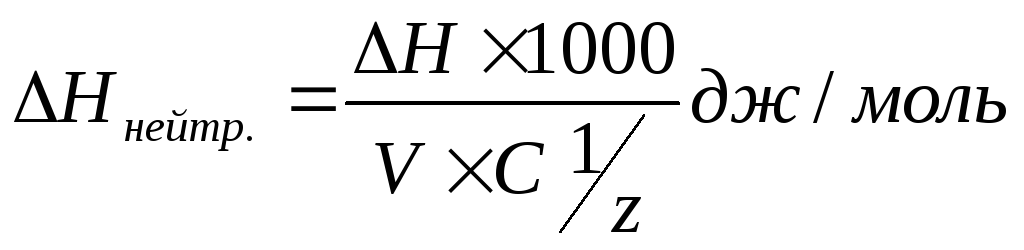 1)2NaOH+H₂SO₄→Na₂SO₄+2H₂O+61,7
кдж ;2)NaHSO₄+NaOH→Na₂SO₄+H₂O=69.7
кдж. В химической индустрии термоэффекты
необходимы для расчета количества
теплоты для нагревания реакторов, в
которых идут эндотермические реакции.
В энергетике с помощью теплот сгорания
топлива рассчитывают выработку тепловой
энергии.
Врачи-диетологи употребляют
термоэффекты окисления пищевых товаров
в организме для составления правильных
рационов питания не лишь для больных,
но и для здоровых людей - спортсменов,
работников разных профессий. По традиции
для расчетов тут употребляют не джоули,
а остальные энергоединицы - калории (1
кал = 4,1868 Дж). Энергетическое содержание
пищи относят к какой-нибудь массе пищевых
товаров: к 1 г, к 100 г либо даже к обычной
упаковке продукта
1)2NaOH+H₂SO₄→Na₂SO₄+2H₂O+61,7
кдж ;2)NaHSO₄+NaOH→Na₂SO₄+H₂O=69.7
кдж. В химической индустрии термоэффекты
необходимы для расчета количества
теплоты для нагревания реакторов, в
которых идут эндотермические реакции.
В энергетике с помощью теплот сгорания
топлива рассчитывают выработку тепловой
энергии.
Врачи-диетологи употребляют
термоэффекты окисления пищевых товаров
в организме для составления правильных
рационов питания не лишь для больных,
но и для здоровых людей - спортсменов,
работников разных профессий. По традиции
для расчетов тут употребляют не джоули,
а остальные энергоединицы - калории (1
кал = 4,1868 Дж). Энергетическое содержание
пищи относят к какой-нибудь массе пищевых
товаров: к 1 г, к 100 г либо даже к обычной
упаковке продукта
Адсорбционное
равновесие, т.е. равномерное распределение
вещества между пограничным слоем и
граничащими фазами, является динамическим
равновесием и быстро устанавливается.
Адсорбция уменьшается с повышением
температуры. Мономолекулярная
адсорбция с точки зрения термодинамики
процесса выражается химическим
потенциалом в адсорбционном слое и
объемной фазе:![]() ;
;![]() ;
;![]() ,где
,где ![]() -
химический потенциал вещества в
адсорбционном слое;
-
химический потенциал вещества в
адсорбционном слое;![]() -
химический потенциал вещества в объемной
фазе. При равновесии потенциалы равны:
-
химический потенциал вещества в объемной
фазе. При равновесии потенциалы равны: ![]() .
.
.Хемосорбция – химическая реакция, поглощение одного вещества другим.(адсорбат вступает в химическую связь с адсорбентом). Адсорбция – изотермический процесс. При физической адсорбции выделяется энергия от 4 до 40. Адсорбция жидкости имеет свои особенности: на некотором активном центре адсорбируется сам растворитель, но могут адсорбироваться и ионы. Адсорбцию в случае . когда требуется подчеркнуть природу сил взаимодействия, называют физической адсорбцией.
Б12.Современные представления о строении атома: изучение атомных орбиталей, показало, что характер движения электрона в атоме определяется четырьмя числами n,l,m,s, получившими общее название квантовых. Электронная оболочка атома – это совокупность всех электронов в данном атоме. Электрон имеет двойственную природу, он одновременно является и частицей и волной→квантово механическая теория структуры атома. Часть атомного пространства, в которой вероятность нахождения электрона наибольшая (≈90z) называется атомной орбиталью. Энергия и размер орбитали и электронного облака характеризуется главным квантовым числом – n. Совокупность орбиталей, которые имеют одинаковое значении главного квантового числа – это энергетический уровень. Совокупность электронов , которые находятся на одном энергетическом уровне . эл. Слой. Форма орбиталей и облаков характеризуется побочным (орбитальным) квантовым числом l. Энергетический подуровень – совокупность орбиталей .которые находятся на одном энергетическом уровне и имеют одинаковую форму. Орбитали одного подуровня имеют одинаковые значения главного квантового числа (n) и одинаковые значения побочного квантового числа. Число подуровней на уровне тоже равно главному квантовому числу. Магнитное квантовое число m характеризует направление орбиталей (электронных облаков) в пространстве. Электрон характеризуется спиновым квантовым числом. Принцип Паули : в системе не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Адсорбцией называется изменение концентрации вещества на границе раздела фаз. На поверхности жидкости создается пленка которая обладает аномальными свойствами. Поверхностное натяжение растворов зависит от природы растворителя и растворенного вещества, от концентрации последнего и от температуры. Зависимость пов. Нат. Растворов при постоянной температуре от концентрации растворенного вещества называется изотермой поверхностного натяжения. Растворенные вещества понижают поверхностное натяжение растворителя, в таком случае их называют поверхностно активными веществами, если понижают поверхностное натяжение – поверхностно неактивными веществами. ПАВ- активные полярные органические соединения (спирты, амины. Кислоты,фенолы). П.Неак.В. большинство сильных электролитов. Нарисовать график изотермы адсорбции.
Б13.Принципы заполнения эл. Оболочек Fe +26 (k-2;l-8;m-14;n-2) 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Электроны центрального иона распределяются по d орбиталям так, чтобы образовалась система с минимальной энергией. Это может быть достигнуто двумя способами: размещением электронов на dе орбиталях, отвечающих более низкой энергии, или равномерным распределением их по всем d орбиталям в соответствии с правилом Хунда. Константы нестойкости для различных комплексных ионов весьма различны и могут служить мерой устойчивости комплекса. Чем меньше концентрация продуктов распада,т.е. чем устойчивее комплекс,тем меньше его константа нестойкости.
Б32. Катализ – ускорение или замедление реакции под воздействием катализатора. Катализ положительный- ускоряет хим.реакцию,отрицательный-замедляет.Ктализатор способен понижать энергию активации (Еа). : 1)А+В→АВ (U) 2)А+ кат→Акат (V₁) 3)В+Акат→АВ+кат. (V₂) V₁+V₂→U. Виды: гомогенный – однородный,все в одном агрегатном состоянии; гетерогенный – неоднородный. Теория гетероген.: на катализаторе есть активные участки – каталитические ядра, создаваемые удачное пространство строения реагирующих в-в : CO+2H₂→Cu→CH₃OH;CO+H₂→Ni→CH₄.
Б14.При
диссоциация комплексного соединения
образуется ион внешней и внутренней
сферы.
Частицы , находящиеся во внешней сфере,
Связаны с комплексным ионом преимущественно
электростатическими силами и легко
отщепляются в водном растворе. Эта
диссоциация называется первичной , она
протекает почти нацело, по типу диссоциации
сильных электролитов. Лиганды, находящиеся
по внутренней сфере, связаны с центральным
атомом значительно прочнее и отщепляются
лишь в незначительной степени. Обратимый
распад внутренней сферы к.с. носит
нгазвание вторичной диссоциации.Она
характеризуется наличием равновесия
между комплексной частицей,центральным
ионом и лигандами. Для комплексных
соединений прежде всего характерны те
же свойства, что и для обычных соединений
тех же классов (соли, кислоты, основания).Если
комплексное соединение кислота, то это
сильная кислота, если основание, то и
основание сильное. Эти свойства
комплексных соединений определяются
только наличием ионов H3O![]() или
OH
или
OH![]() .
Кроме этого комплексные кислоты,
основания и соли вступают в обычные
реакции обмена, например:[Cu(NH3)4]SO4 +
BaCl2 = BaSO4
.
Кроме этого комплексные кислоты,
основания и соли вступают в обычные
реакции обмена, например:[Cu(NH3)4]SO4 +
BaCl2 = BaSO4![]() +
[Cu(NH3)4]Cl2;FeCl3 + K4[Fe(CN)6] = Fe4[Fe(CN)6]3
+
[Cu(NH3)4]Cl2;FeCl3 + K4[Fe(CN)6] = Fe4[Fe(CN)6]3 ![]() +
3KCl;Cu(H2O)4]2
+
3KCl;Cu(H2O)4]2![]() +
4NH3 = [Cu(NH3)4]2
+
4NH3 = [Cu(NH3)4]2![]() +
4 H2O; AgBr + 2S2O32
+
4 H2O; AgBr + 2S2O32![]() =
[Ag(S2O3)2]3
=
[Ag(S2O3)2]3![]() +
Br
+
Br![]() ;FeCl2кр +
6CN
;FeCl2кр +
6CN![]() =
[Fe(CN)6]4
=
[Fe(CN)6]4![]() +
2Cl
+
2Cl![]() ,а
также кислотно-основные реакции типа
[Zn(OH)4]2
,а
также кислотно-основные реакции типа
[Zn(OH)4]2![]() +
2H3O
+
2H3O![]() =
[Zn(H2O)2(OH)2]
=
[Zn(H2O)2(OH)2]![]() +
2H2O;[Zn(H2O)4]2
+
2H2O;[Zn(H2O)4]2![]() +
2OH
+
2OH![]() =
[Zn(H2O)2(OH)2]
=
[Zn(H2O)2(OH)2]![]() +
2H2O
+
2H2O
