
Уроки Хімії / Старовойтова І. Ю. Хімія. Розробки уроків для 9 класу
.pdf
Серія «Мій конспект» Заснована 2008 року
Книга скачана с сайта http://e kniga.in.ua
Издательская группа «Основа» — «Электронные книги»
Харків Видавнича група «Основа»
2012
УДК 37.016 ББК 74.262.4 С77
Автори:
Старовойтова І. Ю., канд. хім. н., учитель хімії вищої категорії, учитель-методист ліцею «Колеж», м. Донецьк
Люсай О. В., учитель хімії вищої категорії, учительметодист ліцею «Колеж», м. Донецьк
Старовойтова І. Ю.
С77 Хімія. 9 клас / І. Ю. Старовойтова, О. В. Люсай. — Х. : Вид. група «Основа», 2012. — 126 [2] с. — (Серія «Мій конспект»).
ISBN 978-611-00-0233-2.
Посібник містить розробки всіх уроків хімії для 9 класу за чинною програмою загальноосвітньої школи. У розробках уроків широко використовуються сучасні наукові дані й прогресивні педагогічні технології. Докладно описано проведення всіх лабораторних і практичних робіт, передбачених програмою. Для всіх тем наведено кілька варіантів завдань для перевірки знань з теми. Посібник має перфоровані відривні аркуші з полями для внесення змін та доповнень до уроку.
УДК 37.016 ББК 74.262.4
Навчальне видання
Серія «Мій конспект»
Старовойтова Ірина Юріївна Люсай Олена Вікторівна
хіміЯ. 9 клас
Навчально-методичний посібник
Головний редактор К. М. Задорожний
Редактор Л. В. Мариненко Коректор О. М. Журенко
Технічний редактор О. В. Лєбєдєва Комп’ютерне верстання Ю. О. Неджеря
Підп. до друку 07.07.2009. Формат 60×90/8. Папір офсет. Гарнітура Шкільна. Друк офсет. Ум. друк. арк. 8,0. Зам. № 9—07/03—05.
ТОВ «Видавнича група “Основа”».
Свідоцтво суб’єкта видавничої справи ДК № 2911 від 25.07.2007. Україна, 61001 Харків, вул. Плеханівська, 66.
Тел. (057) 731-96-32. E-mail: chem@osnova.com.ua
Віддруковано з готових плівок ПП «Тріада+» Свідоцтво суб’єкта видавничої справи ДК № 1870 від 16.07.2007.
Харків, вул. Киргизька, 19. Тел.: (057) 757-98-16, 757-98-15.
ISBN 978-611-00-0233-2
©Старовойтова І. Ю., Люсай О. В., 2009
©ТОВ «Видавнича група “Основа”», 2012

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 1
Тема уроку. Основні класи неорганічних сполук Цілі уроку: повторити хімічні поняття, розглянуті під час вивчення
хімії 8 класу; узагальнити й систематизувати знання про класи неорганічних сполук, їх генетичні зв’язки, хімічні властивості.
Тип уроку: узагальнення й систематизації знань. Форми роботи: фронтальна бесіда, групова робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, опорні схеми.
Хід уроку
І. Організація класу
ІІ. Актуалізація опорних знань
Фронтальна бесіда
yy Назвіть основні поняття й закони, вивчені у 8 класі. Дайте визначення поняттям: моль, молярна маса, молярний об’єм та ін.
yy Наведіть формулювання законів: yy збереження маси;
yy об’ємних відносин; yy періодичного закону.
ІІІ. Узагальнення й систематизація знань
1. Розминка (фронтальна робота)
Учні відгадують хімічні загадки.
1) Кислота тепла боится, быстро в воду превратится. (Карбонатна, суль-
фатна кислоти)
2) Самой сильной из кислот имя галоген дает. (Хлоридна кислота) 3) Капля воды попала на кусок и превратилась в кипяток. (Розчинення луж-
ного металу у воді)
4) Молоко не скисло, на стене повисло. (Вапняне молоко)
5) Природной соли маленький кусок отвечать помог урок. (Кальцій карбо-
нат, крейда)
6) Порознь каждый ядовит, вместе будет — аппетит. (Натрій хлорид)
2. Класи неорганічних сполук
Речовини
|
|
Прості |
|
|
|
|
|
Складні |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Метали |
|
|
Неметали |
|
Оксиди |
|
Кислоти |
|
Основи |
|
Солі |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
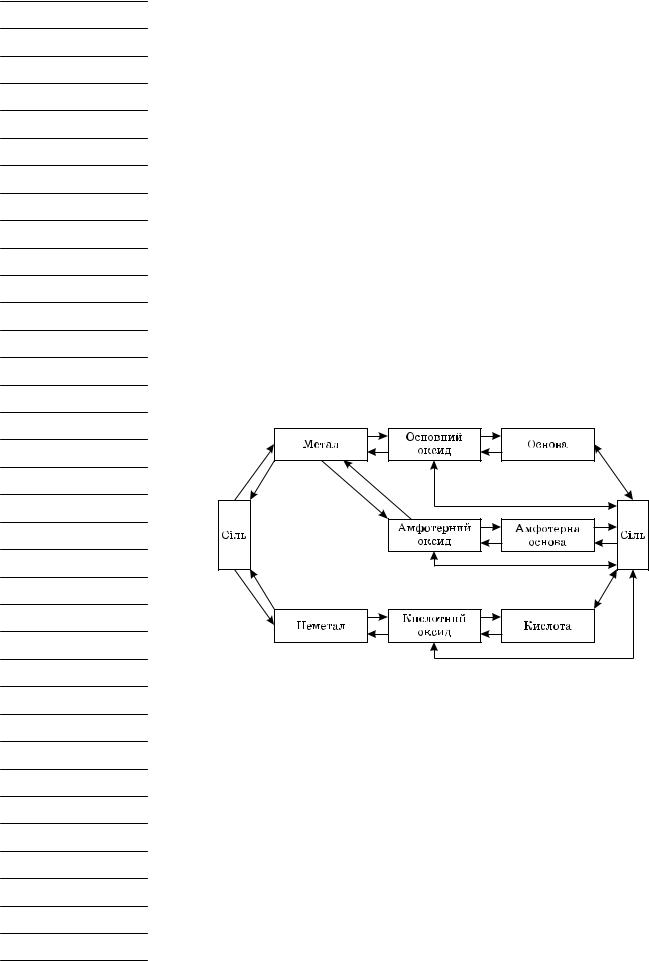
А. Оксиди — складні сполуки, що складаються з двох хімічних елементів, один з яких — Оксиген валентністю II.
Б. Основи — складні речовини, що складаються з атомів металів, з’єднаних з однією або кількома гідроксильними групами.
В. Кислоти — складні речовини, утворені одним або кількома атомами Гідрогену, з’єднаними з кислотним залишком.
Г. Солі — складні речовини, утворені атомами металів, з’єднаними з кислот ними залишками.
Згадаймо основні способи одержання солей різних металів.
3
А. Нормальних (середніх):
3KOH +H3PO4 = K3PO4 +3H2O
Основу й кислоту взято для взаємодії в стехіометричних кількостях (тобто вони реагують одна з одною без залишку).
Б. Кислих:
2KOH +H3PO4 |
= |
K2HPO4 |
+2H2O |
нестача надлишок |
|
калiй |
|
|
|
дигiдрогенфосфат |
|
KOH +H3PO4 = |
KH2PO4 |
+H2O |
|
|
|
калiй |
|
дигiдрогенфосфат
Для одержання кислих солей кислота береться в надлишку, а основа — у нестачі.
В. Основних:
Al(OH)3 |
+2HCl = AlOHCl2 +2H2O |
||
багато |
|
мало |
алюмiнiй |
|
|
|
гiдроксихлорид |
Al(OH)3 |
+ HCl = Al(OH)2 Cl+2H2O |
||
дуже багато |
|
дуже мало |
алюмiнiй |
дигiдрогенхлорид
Завдання 1. Допишіть рівняння реакцій.
Mg +H2SO4 = MgSO4 +H2
CuOHCl +HCl = CuCl2 +H2O
KHCO3 +KOH = K2CO3 +H2O
Для одержання основних солей основа береться в надлишку, а кислота — у нестачі.
3. Генетичний зв’язок класів неорганічних сполук
Завдання 2 (робота в парах). Здійсніть перетворення за схемами.
1) CaO →CaSO4 →CaCO3 →CaO 2) Na →NaOH →Fe(OH)3 →Fe2O3
3) CuSO4 →Ca(OH)2 →CuCl2 →FeCl2 →Fe(OH)2
4) Al2O3 → Al2 (SO4 )3 → Al(OH)3 →KAlO2 5) S →SO2 →SO3 →H2SO4 →BaSO4
6) KOH →Zn(OH)2 →K2ZnO2 →ZnSO4 7) FeCl3 →Fe(OH)3 →Fe2O3 →Fe 8) Mg →MgO →MgSO4 →MgCl2
IV. Підбиття підсумків уроку
Учні разом з учителем перевіряють правильність заповнення схеми, виправляють помилки. Учитель підбиває підсумки уроку, оцінює, заохочує найбільш активних учнів.
V. Домашнє завдання
Повторити основні класи неорганічних сполук.
4

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 2
Тема уроку. Періодичний закон, періодична система хімічних елементів Д. І. Менделєєва. Хімічний зв’язок, будова речовини
Цілі уроку: узагальнити й систематизувати знання учнів про періодичне повторення властивостей хімічних елементів і речовин, утворенихцимиелементами;розширитиуявленняучнівпро будову атома, зв’язок між будовою атомів та їх положенням у періодичній системі; повторити види хімічного зв’язку, типи кристалічних ґраток, зв’язок між будовою атомів, хімічним зв’язком і будовою речовини.
Тип уроку: узагальнення й систематизації знань. Форми роботи: фронтальна, групова, індивідуальна.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, картки із завданнями.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання. Актуалізація опорних знань
Фронтальна бесіда
1) Наведіть формулювання періодичного закону Д. І. Менделєєва. 2) Наведіть сучасне формулювання періодичного закону. 3) Зобразіть будову атома та йона:
а) Хлору; б) Натрію.
4) Зобразіть електронну схему утворення молекули між цими атомами, укажіть тип хімічного зв’язку.
5) Укажіть положення в періодичній системі найсильнішого металу. Обґрунтуйте свою думку.
6) Укажіть положення в періодичній системі найсильнішого неметалу. Обґрунтуйте свою думку.
7) Яке місце в періодичній системі займають інертні елементи?
ІІІ. Узагальнення й систематизація вивченого матеріалу
1. Будова атома. Квантові числа. Принцип заповнення електронних орбіталей
yy Як визначається положення електронів у атомі? Подвійна (корпускулярно-хвильова) природа електрона.
Квантові числа електронів
Головне квантове число (n).
Завдання 1 (робота по ланцюжку). Назвіть число енергетичних рівнів у атомі елемента: Ферум, Натрій, Сульфур, Силіцій, Бром, Радій.
Що таке електронна орбіталь?
Яких форм можуть набувати електронні орбіталі? Орбітальне квантове число (l).
Згадайте, які електрони можуть розташовуватися на першому рівні; на другому рівні; на третьому рівні. (Заповнюємо таблицю.)
Магнітне квантове число (m). yy Що таке «спін»?
Спінове квантове число (s).
Принципи заповнення орбіталей
1. Принцип Паулі
2. Енергія орбіталей зростає в ряді:
1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <5d′′ <4f <6p <7s.
5

3. Правило Хунда
Повна електронна формула елемента
Електронна конфігурація (електронна формула) атома
Завдання 2. Порівняйте схему будови атома, електронну і графічну формули будови атома:
а) Оксигену й Магнію; б) Калію та Хлору; в) Калію та Скандію.
2. Фізичний зміст хімічної періодичності
Графічним зображенням періодичного закону є періодична таблиця. yy Що таке період у періодичній системі?
yy Скільки елементів може знаходитися в кожному періоді?
Періоди
yy Чим визначаються металічні й неметалічні властивості елементів?
Металічні та неметалічні властивості атомів елементів
Хімічно інертні атоми. Великі періоди yy Що таке групи в періодичній системі?
yy Які елементи об’єднуються в головні та побічні підгрупи?
yy s-елементи, p-елементи, d-елементи (елементи побічних підгруп), f-еле менти.
3. Групова робота
На підставі періодичної таблиці охарактеризуйте хімічні елементи з порядковими номерами: 11, 9, 7, 17, 13, 10 за планом:
1. Положення в періодичній таблиці (порядковий номер; період, ряд; група, підгрупа; атомна маса)
2. Будова атома (заряд ядра; склад ядра — кількість протонів p11, нейтронів n01 та електронів e−; кількість енергетичних рівнів і підрівнів; формула електронної конфігурації; квантові комірки; за числом і характером валентних електронів визначити тип елемента)
3. Формули й хімічний характер сполук (вищого оксиду й гідроксиду; сполук із Гідрогеном)
4. Порівняти із сусідами (у періоді, у групі)
Учні складають звіт про виконане завдання, подають його на обговорення в класі, по черзі коментують помилки. Учитель узагальнює й оцінює відповіді.
IV. Підбиття підсумків уроку
Учитель підбиває підсумки уроку, оцінює роботу учнів.
V. Домашнє завдання
Повторити матеріал про будову атомів, хімічний зв’язок, будову речовини.
6
І семестр |
Клас |
Дата проведення уроку |
|
|
|
Тема 1. Розчини (18 год)
Урок 3
Тема уроку. Значеннярозчинівуприродійжиттєдіяльностілюдини.Поняття про дисперсні системи, колоїдні та істинні розчини
Цілі уроку: розвивати знання учнів про розчини; формувати уявлення учнів про розчини як багатокомпонентні системи; ознайомитизкласифікацієюрозчинів;показатизначеннярозчинів у природі й життєдіяльності людини.
Тип уроку: засвоєння нових знань.
Форми роботи: евристична бесіда, самостійна робота зі схемою, групова робота.
Обладнання: схемакласифікаціїдисперснихсистем,прикладидисперсних систем.
Хід уроку
І. Організація класу
ІІ. Мотивація навчальної діяльності
(На дошці записано тему уроку.)
Розчини добре знайомі кожній людині. yy Що ж таке, на вашу думку, розчини?
yy Наведіть приклади розчинів, які ми використовуємо в побуті. yy Наведіть приклади розчинів, які існують у природі.
yy Наведіть приклади розчинів, які використовуються в промисловості. (Деякі відповіді учнів записуємо на дошці в три стовпчики, за необхідності
доповнюємо й коментуємо.)
yy Чи можна стверджувати, що розчини бувають лише рідкими? yy Наведіть приклади газоподібних розчинів.
yy Скільки компонентів може входити до складу розчину? yy Чим розчин відрізняється від суміші?
yy Чим розчин відрізняється від складної речовини?
yy Що відбувається з речовинами в процесі утворення розчинів?
Щоб відповісти на ці питання, нам потрібно більш докладно вивчити суть процесу розчинення та явища, що супроводжують розчинення речовин.
Загалом можна стверджувати, що розчин — це суміш двох і більше компонентів, які рівномірно розподілені один в одному.
ІІІ. Вивчення нового матеріалу
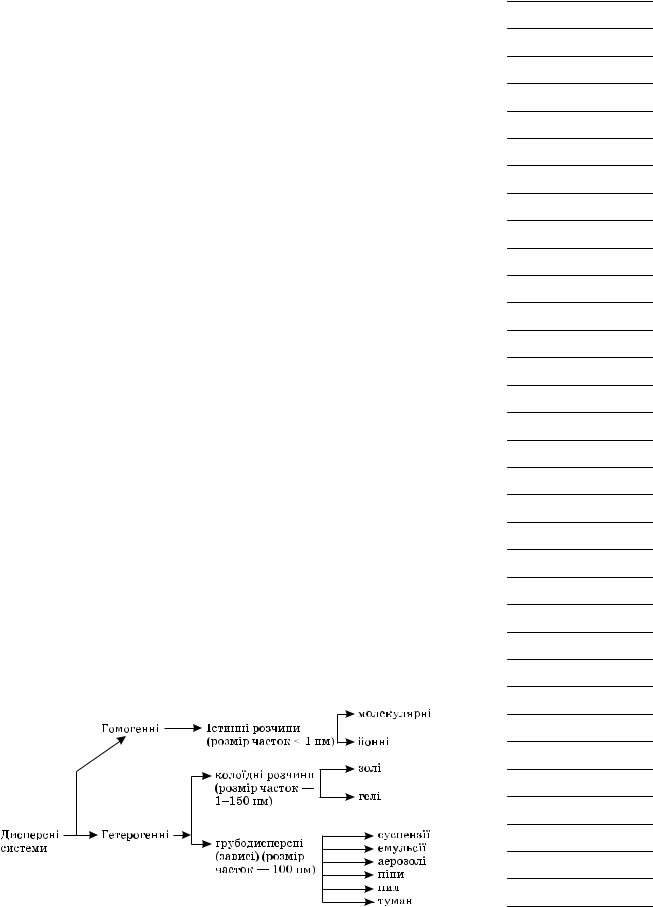
Щоб оцінити поширення розчинів у природі й життєдіяльності людини, розгляньмо схему класифікації розчинів за агрегатним станом і розмірами частинок.
7

Розглядаємо схему, характеризуємо дисперсні системи, наводимо приклади, демонструємо приклади дисперсних систем. Супроводжуємо розповідь демонстрацією наявних дисперсних систем, пропонуємо учням навести приклади з життя.
Гетерогенні системи
Грубодисперсні розчини — зависі, характеризуються тим, що частки речовини в розчині мають досить великі розміри, які можна розрізнити оком.
Суспензії — зависі, у яких частки твердої речовини рівномірно розподілені між молекулами рідини (кава, ліки, фарби).
Емульсії — зависі, у яких крапельки однієї рідини рівномірно розподілені між молекулами іншої рідини, якщо рідини нерозчинні одна в одній (молоко, олія у воді).
Аерозолі — зависі, у яких крапельки рідини рівномірно розподілені між молекулами газоподібної речовини (туман, лак для волосся, балон з отрутохімікатами).
Піни — зависі, у яких газоподібні речовини рівномірно розподілені в рідкій речовині (збиті вершки, мильна піна).
Пил — зависі, у яких частки твердої речовини рівномірно розподілені в газоподібній речовині (смог).
Колоїдні розчини — дисперсні системи, у яких розміри часток досить малі, не видимі неозброєним оком, але помітні з допомогою спеціальних приладів. (Розглядаємо в підручнику рисунок або демонструємо ефект Тіндаля на прикладі крохмалю.)
Особливістю гетерогенних дисперсних систем є те, що вони нестійкі та з часом розпадаються на компоненти.
Істинні розчини — однорідні системи, що складаються з молекул розчиненої речовини й розчинника.
Особливістю істинних розчинів є те, що неможливо розглянути їх окремі компоненти, системи стійкі та зберігаються протягом тривалого часу.
IV. Узагальнення й систематизація знань
Ми ознайомилися з класифікацією розчинів, навели чимало прикладів. Тепер пропонуємо об’єднатися в групи й заповнити схеми:
1. Значення розчинів у природі.
2. Значення розчинів у побуті та промисловості. 3. Значення розчинів у промисловості.
Групи учнів протягом 5–7 хвилин працюють з однією зі схем, після чого схеми вивішуються на дошці, обговорюються, за необхідності доповнюються.
V. Підбиття підсумків уроку
Пропонуємо учням назвати по одному новому поняттю, з яким вони ознайомилися сьогодні на уроці, і коротко його прокоментувати.
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на питання до нього, виконати вправи.
Творче завдання: підготувати оповідання, есе, вірш про роль розчинів.
8

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 4
Тема уроку. Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок
Цілі уроку: формувати уявлення учнів про склад розчинів; ознайомити з властивостями води як універсального розчинника.
Тип уроку: засвоєння нових знань. Форми роботи: фронтальна бесіда.
Обладнання: таблиця розчинності, класифікація розчинів, схема будови молекули води, опорна схема.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання. Актуалізація опорних знань
Учні за бажанням зачитують творчі завдання.
yy На які дві групи поділяються дисперсні системи? yy З яких компонентів складається розчин?
yy Чи можна стверджувати, що розчини мають постійний склад? Чому?
ІІІ. Сприйняття й первинне засвоєння нового матеріалу
Розчини — це багатокомпонентні системи. Один із компонентів називається розчинником. Зазвичай це речовина, що перебуває в тому ж агрегатному стані, що й розчин. Якщо всі компоненти розчину перебувають в одному агрегатному стані, то розчинником уважається той компонент, якого в розчині більше.
У тому випадку, якщо одним із компонентів є вода, то саме вона й буде розчинником.
Вода — універсальний розчинник усіх речовин на Землі. yy Наведіть приклади водних розчинів.
yy Наведіть приклади неводних розчинів.
За реакцією з водою всі речовини поділяються на три групи: yy розчинні;
yy малорозчинні;
yy практично нерозчинні.
Звертаємося до таблиці розчинності, згадуємо, як використовувати цю таблицю для визначення розчинності речовин у воді.
yy Як можна пояснити таку особливість молекул води? Звернемося до будови молекули води й розглянемо схему.
Hδ+ −Oδ−
Н
Тип зв’язку — ковалентний полярний, кут зв’язку — 104,5°. Тип кристалічної ґратки — молекулярний.
yy Ґратка молекулярна? Чому ж за нормальних умов вода — рідина? Молекула води полярна — диполь. Між молекулами води виникає взаємне
притягання за температури менш ніж 100 °С. Такий зв’язок називається водневим.
Розглядаємо схему водневого зв’язку між молекулами води.
9

Такий зв’язок можливий між молекулами води й молекулами полярних розчинених речовин. Така особливість молекул води — одна з причин її розчинної сили.
IV. Закріплення знань, осмислення об’єктних зв’язків і відносин
Згадуємо властивості води (на підставі знань про воду заповнюємо опорну схему).
Молекулярна формула: _________________
Структурна формула: _________________
M(H2O) =_________________
Поширення в природі
В організмі людини: _________________
На Землі: _________________
У Космосі: _________________
Фізичні властивості
За атмосферного тиску 1 атм:
Ткип = 100 °С,
Тплав = 0 °С,
ρ = 1 г/см3.
Агрегатні стани:


Хімічні властивості
1. H2O +Me2On →Me(OH)n (якщо Ме — активний, а основа — розчинна або малорозчинна)
Na2O +H2O →
CaO +H2O →
CuO +H2O →
2. H2O +X2On →H2X2On+1 (крім SiO2 ) P2O5 +H2O →
CO2 +H2O →
SO2 +H2O →
3. H2O +Me →Me(OH)n +H2 (якщо Ме — активний) K +H2O →
Ca +H2O →
Cu +H2O →
Завдання 1
Обчисліть масу води, що утворюється внаслідок згоряння водню об’ємом
1,12 л (за н. у.).
Обчисліть об’єм пари води цієї маси.
Завдання 2
Обчисліть масу лугу, що утворюється в процесі розчинення у воді калію масою 3,9 г.
V. Підбиття підсумків уроку
Учитель підбиває підсумки уроку, оцінює роботу учнів.
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Розв’язати задачу:
Обчисліть, яку масу сульфатної кислоти можна одержати з 3,2 г сірки.
10
