
- •Молекулярная абсорбционная спектроскопия. Основной закон светопоглощения. Практическое применение метода. Абсорбционная спектроскопия. Основной закон светопоглощения (закон б-л-б).
- •Спектры поглощения.
- •1. Вращательные спектры.
- •2. Колебательные спектры.
- •3. Электронные спектры.
- •Интенсивность поглощения.
- •Источники света.
- •Монохроматизаторы (монюроматоры).
- •Приемники света (рецепторы).
- •Качественный анализ.
- •Количественный анализ.
- •Практическое применение.
Качественный анализ.
Наибольший интерес с точки зрения качественного анализа представляют колебательные (вернее колебательно-вращательные) спектры. Экспериментальные исследования колебательно-вращательных спектров показали, что полосы при некоторых частотах можно привести в соответствие с колебаниями определенных групп атомов или отдельных атомов в молекуле. Такие частоты назвали характеристическими. Различные молекулы, содержащие одну и ту же связь или одну и ту же атомную группировку, будут давать в ИК-спектре полосы поглощения в области одной и той же характеристической частоты. Это и является основой качественного анализа по инфракрасным спектрам. Например, полосы в области 3000...3600 см -1 могут быть приписаны только О—Н- или N—Н-связям.
К настоящему времени изучены и сведены в соответствующие атласы и таблицы инфракрасные спектры более чем 20000 соединений, что существенно облегчает практическое проведение анализа. Для получения первых ориентировочных данных часто пользуются так называемой картой Колтупа, на которой указаны спектральные области появления многих характеристических частот и их возможное отнесение. Инфракрасная спектроскопия с успехом используется и в анализе неорганических веществ. Например, характеристическая частота CO2-3составляет 1450 см-1, SO2-4—1130, NO -3 — 1380, NH+4 — 3300 см -1 и т. д. Электронные спектры поглощения для целей качественного анализа используются значительно реже, чем колебательные, так как они обычно бывают представлены небольшим числом широких полос поглощения, которые часто накладываются одна на другую и полностью или частично перекрываются.
Количественный анализ.
Методы количественного анализа основаны на законе Бугера-Ламберта-Бера. Основными параметрами фотометрического определения являются длина волны, при которой производится измерение, оптическая плотность, толщина кюветы и концентрация окрашенного раствора. Существенное влияние оказывают различные химические факторы, связанные с полнотой и условиями протекания фотометрической реакции, концентрацией окрашенных и других реактивов, их устойчивостью и т. д. В зависимости от свойств анализируемой системы и характеристик применяемого фотометрического прибора выбирают те или иные условия анализа.
Оптимальные условия фотометрического определения.
Длина волны. При определении в растворе одного светопоглощающего вещества аналитическую длину волны, как правило, выбирают на максимуме полосы поглощения. Если в спектре имеется несколько полос, выбор обычно останавливают на наиболее интенсивной, так как работа в области максимума светопоглощения обеспечивает наиболее высокую чувствительность определения. Плоские максимумы более предпочтительны, так как при этом меньше сказывается погрешность в установлении длины волны, чем в случае острых максимумов или крутоспадающих участков кривой. Желательно также, чтобы чувствительность приемника излучения в области аналитической длины волны была максимальна.
Светопропускание (оптическая плотность). Измерительное устройство фотометрического прибора обычно имеет постоянную ошибку D T в величине коэффициента пропускания Т во всем интервале его значений. Ошибка в единицах оптической плотности D A в связи с этим во всем интервале не будет одинакова. Поэтому при решении некоторых задач удобнее оперировать с коэффициентом пропускания, а не с оптической плотностью. Относительная погрешность резко возрастает при очень малых и очень больших значениях Т. В области средних значений Т кривая проходит через минимум (рис.7). Наибольшая точность измерения. будет достигаться. при lnT+1=0,т.е.при значении оптической плотности А=0,435.
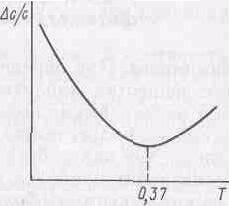
Рис.7. Зависимость относительной погрешности от пропускания раствора
При расчете не учитывалась погрешность за счет других источников, как, например, погрешность при установлении прибора на нулевое и полное пропускание. Более строгое теоретическое рассмотрение и опыт показали, что оптимальная оптическая плотность находится при 0,6...0,7.
Толщина светопоглощающего слоя. Уравнение закона Бугера-Ламберта-Бера показывает, что чем больше толщина слоя, тем больше оптическая плотность и, следовательно, тем более чувствительным будет определение при прочих равных условиях. Однако с увеличением толщины слоя (длины оптического пути) возрастают потери на рассеяние света, особенно при работе с растворами. Кюветы с толщиной слоя большей чем 5 см для фотометрии растворов обычно не применяются.
Концентрационные условия проведения фотометрической реакции. В уравнение основного закона светопоглощения входит концентрация окрашенного (светопоглощающего) соединения, поэтому превращение определяемого компонента в такое соединение является одной из важнейших операций, в значительной степени определяющей точность анализа. Окрашенные соединения в растворе получают в результате, главным образом, реакций окисления — восстановления и комплексообразования. Окислительно-восстановительные реакции, применяемые в фотометрии, например окисление марганца до MnO-4, протекают, как правило, практически полностью до конца.
Значительно более сложным является вопрос о концентрационных условиях протекания в растворе реакций комплексообразования. Осложняющее влияние здесь могут оказать процессы ступенчатого комплексообразования, протолитические равновесия, недостаточная устойчивость образующегося комплекса, собственная окраска реагента и т. д. Действие большинства этих факторов можно предвидеть, если равновесия в интересующей системе достаточно подробно изучены и константы соответствующих равновесии известны (константы устойчивости координационных соединений, диссоциации реагентов и т, д.). Используя эти данные, можно рассчитать, например, при каких значениях рН и концентрации реагента будет достигнута необходимая полнота реакции, как будут влиять сопутствующие элементы и т. д.
Чувствительность и точность метода. Минимальную концентрацию, которую можно определить фотометрическим методом, обычно рассчитывают по соотношению
cmin=Amin /(e l).
Если для ориентировочных расчетов принять, что Amin = 0,01 , l=1 см и e =103, то
cmin=0,01/103 =1*10 -5 моль/л.
Это не минимальная концентрация фотометрического метода, так как e может быть на несколько порядков больше. Точность фотометрических методов зависит от индивидуальных особенностей фотометрической реакции, характеристик применяемого прибора и других факторов и изменяется в довольно широких пределах. Обычная погрешность фотометрических методов составляет примерно 1...2 % (относительных).
Основные приемы фотометрических измерений
Метод градуировочного графика. В соответствии с законом Бугера-Ламберта-Бера график в координатах оптическая плотность – концентрация должен быть линеен и прямая должна проходить через начало координат. Градуировочный график обычно строят не менее чем по трем точкам, что повышает точность и надежность определений. При отклонениях от закона Бугера-Ламберта-Бера, т.е. при нарушении линейной зависимости А от с, число точек на графике должно быть увеличено. Основные ограничения метода связаны с трудностями приготовления эталонных растворов и учетом влияния так называемых третьих компонентов, т. е. компонентов, которые находятся в пробе, сами не определяются, но на результат влияют.
Метод молярного коэффициента поглощения. При работе по этому методу определяют оптическую плотность нескольких стандартных растворов Aст, для каждого раствора рассчитывают e = Aст /(1/ cст) и полученное значение e усредняют. Затем измеряют оптическую плотность анализируемого раствора Ax и рассчитывают концентрацию cx по формуле: cx= Ax /(e l).
Ограничением метода является обязательное подчинение анализируемой системы закону Бугера-Ламберта-Бера, по крайней мере, в области исследуемых концентраций.
Метод добавок. Этот метод применяют при анализе растворов сложного состава, так как он позволяет автоматически учесть влияние “третьих” компонентов. Сущность его заключается в следующем. Сначала определяют оптическую плотность Ax анализируемого раствора, содержащего определяемый компонент неизвестной концентрации cx, а затем в анализируемый раствор добавляют известное количество определяемого компонента (cст) и вновь измеряют оптическую плотность Ax+ст .
Оптическая плотность Ax анализируемого раствора равна: Ax =e l cx
а оптическая плотность анализируемого раствора с добавкой стандартного:
Ax+ст =e l(cx +cст)
Отсюда находим концентрацию анализируемого раствора:
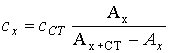
Концентрацию анализируемого вещества в методе добавок можно найти также по графику в координатах Ax+ст =f(cст.) .Если откладывать Ax+ст как функцию cст, то получится прямая, экстраполяция которой до пересечения с осью абсцисс даст отрезок, равный – cx
Метод дифференциальной фотометрии. Фотометрирование интенсивно окрашенных растворов успешно осуществляется методом дифференциальной фотометрии. В обычной фотометрии сравнивается интенсивность света Ix, прошедшего через анализируемый раствор неизвестной концентрации, с интенсивностью света I0, прошедшего через растворитель. Коэффициент пропускания такого раствора будет равен отношению интенсивностей :
Количественный анализ по инфракрасным спектрам. Анализ по ИК-спектрам также основан на применении закона Бугера— Ламберта—Бера. Чаще всего здесь используется метод градуировочного графика. Существенно затрудняется применение метода молярного коэффициента поглощения в ИК-спектроскопии тем, что из-за рассеяния, сплошного поглощения и других эффектов часто бывает невозможно определить положение линии 100%-ного пропускания, т.е. определить интенсивность света, прошедшего через образец без анализируемого компонента (I0).
Многие трудности количественной ИК-спектроскопии успешно преодолеваются с помощью метода базовой линии, который получил большое распространение в практике. Сущность его легко понять из рис. 11, на котором приведен участок ИК-спектра с двумя полосами поглощения (их волновые числа n A и n B). Базовая линия проводится в основании полосы поглощения (она изображена пунктиром). Коэффициент пропускания определяется в этом методе как отношение TA= IA/I0(A) или TB= IB/I0(B) По полученным данным вычерчивают градуировочный график и производят определения.
Определение смеси светопоглощающих веществ. Спектрофо-тометрический метод, в принципе, позволяет определить несколько светопоглощающих веществ в одном растворе без предварительного разделения. Большое практическое значение имеет частный случай такой системы—анализ смеси двух окрашенных веществ. В соответствии с законом аддитивности светопоглощения для такой смеси веществ, например А и
Довольно распространенным примером такого анализа является также определение с помощью реагента, имеющего собственную окраску. Этот метод может быть распространен и на более сложные многокомпонентные смеси. При подчинении светопоглощения отдельных компонентов закону Бугера-Ламберта-Бера и соблюдении закона аддитивности светопоглощения число слагаемых в уравнениях типа (3.21) увеличивается пропорционально числу определяемых компонентов и соответственно возрастает число уравнений. Для решения систем таких уравнений с успехом используются вычислительные машины.
Определение состава и устойчивости комплексных соединений в растворе. Простота и достаточная точность фотометрических измерений привели к широкому использованию фотометрических методов для исследования реакций в растворе и особенно цветных реакций, имеющих химико-аналитическое значение. Для определения состава соединений часто применяется метод изомолярных серий. При использовании этого метода готовят серию растворов, в которых отношение концентрации центрального иона к концентрации лиганда (cM:cL) изменяется от 9:1 до 1:9, а суммарная концентрация (cM+cL) остается одинаковой во всех растворах (изомолярные серии). Затем измеряют оптическую плотность растворов и строят график зависимости оптической плотности от концентрационного отношения cM:cL. Максимум на этом графике указывает состав комплекса. Метод изомолярных серий имеет ограничения и недостатки, однако, является одним из наиболее широко применяемых в практике.
