
- •Курс лекций
- •Часть II «химические методы анализа» содержание
- •Закон действия масс
- •Теория электролитической диссоциации
- •Состояние слабых электролитов в растворе
- •Состояние сильных электролитов в растворе
- •Протолитическая теория Бренстеда-Лоури
- •Выбор идикатора
- •Кислотно-основное титрование (протолитометрия)
- •Редоксиметрия
- •Перманганатометрия
- •Иодометрия
- •Комплексометрия
Выбор идикатора
Выбор индикатора проводят по кривым титрования.
Кривые титрования – графическое отображение изменения аналитического сигнала в процессе титрования (в зависимости от увеличения объема добавленного титранта или от степени оттитрованности раствора) – наглядно показывают ход титрования
1 вариант:
1. Интервал перехода индикатора должен лежать в пределах скачка на кривой титрования.
2. Желательно, чтобы показатель титрования индикатора располагался как можно ближе к точке эквивалентности.
Достоинство: позволяет учесть все индикаторы, возможные к применению при данном титровании.
Недостаток: при не соблюдении 2 (желательного) пункта приводит к некоторому снижению точности титрования.
2 вариант:
Точка эквивалентности должна быть расположена внутри интервала перехода индикатора.
Достоинство: высокая точность фиксирования точки эквивалентности.
Недостаток: ограниченный выбор индикаторов.
Кислотно-основное титрование (протолитометрия)
Метод основан на протолитической реакции в водном растворе:
Н3О+ + ОН– → 2Н2О.
Реакция протекает между веществами с кислотными и основными свойствами. В соответствии с природой титранта методы протолитометрии делятся на ацидиметрию (титрант – кислота, от латинского слова "acid") и алкалиметрию (титрант – щелочь, от латинского слова "alkaly"). Краткая характеристика методов представлена в табл. 5.
Таблица 5
Характеристика методов протолитометрии
|
Метод |
Титрант |
Стандартное вещество |
Объект анализа |
|
Алкалиметрия |
NaОН |
Щавелевая кислота Н2С2О4·2Н2О; янтарная кислота Н6С4О4 |
Сильные и слабые кислоты; соли, образованные слабыми основаниями и сильными кислотами |
|
Ацидиметрия |
НСl |
Карбонат натрия Na2СO3; тетраборат натрия Na2В4О7·10Н2О |
Сильные и слабые основания; соли, образованные слабыми кислотами и сильными основаниями |
Растворы, применяемые в протолитометрии, не имеют окраски, поэтому для визуального фиксирования конечной точки титрования (точки эквивалентности) применяют кислотно-основные индикаторы.
Кислотно-основные индикаторы (рН-индикаторы) – органические кислоты и основания, изменение окраски которых зависит от рН среды. Молекулярная и ионная формы индикаторов имеют различную окраску. Кроме того, изменение окраски связано с таутомерией молекул индикатора. Существуют одноцветные индикаторы, бесцветные в кислой среде и окрашенные в щелочной (например, фенолфталеин), и двухцветные (например, метиловый оранжевый), характеризующиеся различной окраской в кислых и щелочных растворах (табл. 6).
Таблица 6
Некоторые кислотно-основные индикаторы
|
Индикатор |
∆pH |
Изменение окраски |
Окраска в точке эквивалентности |
|
Метиловый фиолетовый |
0–1,8 |
Желтая–фиолетовая |
Зеленая |
|
Тимоловый синий |
1,2–2,8 |
Красная–желтая |
Оранжевая |
|
Метиловый оранжевый |
3,1–4,4 |
Красная–желтая |
Оранжевая |
|
Бромкрезоловый зеленый |
3,9–5,4 |
Желтая–синяя |
Зеленая |
|
Метиловый красный |
4,4–6,2 |
Красная–желтая |
Оранжевая |
|
Бромтимоловый синий |
6,0–7,6 |
Желтая–синяя |
Зеленая |
|
Тимоловый синий |
8,0–9,6 |
Желтая –красная |
Оранжевая |
|
Фенолфталеин |
8,2–9,8 |
Бесцветная–красная |
Розовая |
|
Тимолфталеин |
9,3–10,5 |
Бесцветная–синяя |
Голубая |
|
Ализариновый желтый |
9,7–10,8 |
Желтая –красная |
Оранжевая |
С точки зрения ионной теории индикаторов окраска молекулярной и ионной форм рН-индикатора существенно отличается. В зависимости от рН среды преобладает одна из форм индикатора. Например, фенолфталеин в молекулярной форме бесцветен, его ионная форма окрашена в малиновый цвет:
НInd ↔ Н+ + Ind–
бесцвет. малинов.
При добавлении кислоты равновесие смещается в сторону образования молекул индикатора, которые не имеют окраски. При добавлении к раствору щелочи равновесие смещается в сторону образования ионов индикатора, которые окрашены в малиновый цвет.
Каждый индикатор характеризуется интервалом перехода окраски – интервалом значений рН, внутри которого индикатор изменяет окраску, за его пределами преобладает одна из форм индикатора. Интервал перехода окраски (∆pH) рассчитывают по формуле:
∆pH = рКi ± 1,
где рКi = – lg Кi; Кi – константа ионизации индикатора.
Интервал перехода окраски зависит от природы индикатора и его свойств. Чем меньше интервал перехода окраски, тем ценнее индикатор. Значение рН, при котором заканчивается титрование в присутствии данного индикатора, называется показателем титрования (рТ). Изменение окраски происходит, как правило, при равных значениях концентраций молекулярной и ионной форм индикатора, поэтому во многих системах рТ= рКi.
Требования к кислотно-основным индикаторам:
резко различная окраска индикатора при близких значениях рН;
минимальный интервал изменения окраски;
контрастный переход окраски;
стабильность окраски индикатора;
обратимость изменения окраски.
П ринцип
выбора индикатора: интервал перехода
окраски индикатора должен совпадать с
точкой эквивалентности. Так, при
титровании раствора уксусной кислоты
раствором NaOH протекает реакция:
ринцип
выбора индикатора: интервал перехода
окраски индикатора должен совпадать с
точкой эквивалентности. Так, при
титровании раствора уксусной кислоты
раствором NaOH протекает реакция:
СН3СООН + NaOH СН3СООNa + H2O
или в ионном виде:
С Н3СООН
+ OH–
СН3СОО–
+ H2O.
Н3СООН
+ OH–
СН3СОО–
+ H2O.
В точке эквивалентности вся кислота оттитрована, но за счет смещения равновесия влево, рН раствора определяется наличием сопряженного основания (ионов ОН–).
Титрование заканчивается в щелочной среде, поэтому для фиксирования точки эквивалентности необходим индикатор, имеющий интервал перехода окраски ∆рН > 7 (например, фенолфталеин).
Для точного выбора индикатора рассчитывают кривые титрования.
КРИВЫЕ ТИТРОВАНИЯ
Кривая титрования раствора сильной кислоты сильным основанием (или наоборот).
Титрование раствора NаOH раствором соляной кислоты:
NаOH + HCl→ NаCl + Н2О
С(NаOH)=С(HCl)=0,1 моль/дм3 ; объем раствора V=100 см3
Расчет равновесных
концентраций основания и кислоты
рассчитываем по закону эквивалентов:![]() .
.
|
V,см3 |
Состав раствора |
Ск |
Сосн |
Расчет |
рН |
|
0 |
NаOH |
|
0,1 |
рН=14+lg Сосн=14+lg10–1= 14–1 |
13 |
|
90 |
NаOH |
|
0, 1·10 100 |
рН = 14+ lg 10–2 = 14–2 |
12 |
|
99,9 |
NаOH |
|
0,1·0,1 100 |
рН= 14+lg 10–4= 14–4 |
10 |
|
100 |
NаCl |
– |
– |
рН = 7 |
7 |
|
100,1 |
HCl |
0,1·0,1 100 |
|
рН = –lg Ск = –lg10–4= 4 |
4 |
|
101 |
HCl |
0,1·1 100 |
|
рН = –lg 10–3= 3 |
3 |
|
110 |
HCl |
0,1·10 100 |
|
рН = –lg 10–2= 2 |
2 |
р Н
Н
12
11
10
9
8
7
6
5
4
3
2
По результатам расчета строим кривую титрования в координатах рН – V титранта. Скачок на кривой титрования равен 10–4= 6 ед.
Индикатор для фиксирования точки эквивалентности выбирают таким образом, чтобы интервал перехода его окраски совпадал со скачком на кривой титрования. Из наиболее распространенных индикаторов здесь подойдет метиловый красный (интервал перехода окраски равен ∆рН=4–6) и фенолфталеин (интервал перехода окраски ∆рН= 8–10).
Кривая титрования раствора слабой кислоты сильным основанием.
Уксусная кислота может быть оттитрована раствором гидроксида натрия:
СН3СООН + NaOH→ СН3СООNa + Н2О
В справочной
таблице находим значение рК= 4,76. Расчет
равновесных концентраций кислоты, соли
и основания рассчитываем по закону
эквивалентов:![]() .
.
|
V,см3 |
Состав раствора |
Ск |
Сс |
Расчет |
рН |
|
0 |
СН3СООН |
0,1 |
– |
рН=1/2рКк –1/2 lg Ск= 1/2 4,76– 1/2 lg10–1= 2,38+0,5 |
2,88 |
|
50 |
СН3СООН СН3СООNa |
0,1·50 100 |
0,1·50 100 |
рН = рКк – lg Ск/Сс = 4,2 – lg0,05/0,05= 4,76–0 |
4,76 |
|
90 |
|
0,1·10 100 |
0,1·90 100 |
рН = 4,76 – lg 10–2/10–1 = 4,76 +1 |
5,76 |
|
99,9 |
|
0,1·0,1 100 |
0,1·99,9 100 |
рН = 4,76 – lg 10–4/10–1 = 4,76 + 3 |
7,76 |
|
100 |
СН3СООNa |
– |
0,1·100 100 |
рН = 7 + 1/2рКк + 1/2 lg Сс =7+1/2·4,76+1/2 lg 10–1 |
8,88 |
|
100,1 |
NaOH |
0,1·0,1 100 |
рН =14 – рОН= 14+lg Сосн = 14 + lg 10–4= 14 –4 |
10 | |
|
101 |
NaOH |
0,1·1 100 |
рН = 14 + lg 10–3= 14-3 |
11 | |
|
110 |
NaOH |
0,1·10 100 |
рН = 14 + lg 10–2= 14-2 |
12 | |
По результатам расчета строим кривую титрования в координатах рН – V титранта. Скачок на кривой титрования равен 10 – 7,76= 2,24 ед.
Индикатор для фиксирования точки эквивалентности выбирают таким образом, чтобы интервал перехода его окраски совпадал со скачком на кривой титрования. Из наиболее распространенных индикаторов здесь подойдет фенолфталеин. Интервал перехода окраски равен ∆рН= 8–10. Переход окраски от бесцветного к малиновому.
 рН
рН
12
11
 10
10
9 фенолфталеин т.э. скачок
8
7
6
5
4
3
2
0 50 90 100 110 V,см3
Кривая титрования раствора слабого основания сильной кислотой .
Раствор NН4OH можно оттитровать раствором соляной кислоты:
NН4OH + HCl→ NН4Cl + Н2О
В справочной таблице находим значение рК(NН4OH)=4,75.
С(NН4OH)=С(HCl)=0,1 моль/дм3
Расчет равновесных
концентраций основания, соли и кислоты
рассчитываем по закону эквивалентов:![]() .
.
|
V,см3 |
Состав раствора |
Ск |
Сс |
Расчет |
рН |
|
0 |
NН4OH |
0,1 |
– |
рН=14 – 1/2рКосн +1/2 lg Сосн= 14–1/2 ·4,75+ 1/2 ·lg1·10–1= 11,625–0,5 |
11,12 |
|
50 |
NН4OH NН4Cl |
0,1·50 100 |
0,1·50 100 |
рН = 14–рКосн + lg Сосн/Сс = 14–4,75+ lg0,05/0,05= 9,25–0 |
9,25 |
|
90 |
|
0,1·10 100 |
0,1·90 100 |
рН = 14–4,75+ lg 1·10–2/1·10–1 = 9,25– 1 |
8,25 |
|
99,9 |
|
0,1·0,1 100 |
0,1·99,9 100 |
рН= 14–4,75+lg 1·10–4/1·10–1= 9,25– 3 |
6,25 |
|
100 |
NН4Cl |
– |
0,1·100 100 |
рН = 7 – 1/2рКосн – 1/2 lg Сс =7–1/2·4,75–1/2 lg 1·10–1 |
5,12 |
|
100,1 |
HCl |
0,1·0,1 100 |
рН = –lg Ск = –lg 1·10–4= 4 |
4,0 | |
|
101 |
HCl |
0,1·1 100 |
рН = –lg 1·10–3= 3 |
3,0 | |
|
110 |
HCl |
0,1·10 100 |
рН = –lg 1·10–2= 2 |
2,0 | |
По результатам расчета строим кривую титрования в координатах рН – V титранта. Скачок на кривой титрования мал и равен 6,25–4= 2,25 ед.
Индикатор для фиксирования точки эквивалентности выбирают таким образом, чтобы интервал перехода его окраски совпадал со скачком на кривой титрования. Из наиболее распространенных индикаторов здесь подойдет метиловый красный. Интервал перехода окраски равен ∆рН= 4–6. Переход окраски от желтого в щелочной среде к красному – в кислой.
р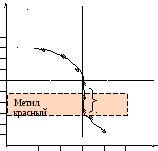 Н
Н
12
11
10
9
8
7
т.э. скачок
6
5
4
3
2
0 50 90 100 110 V,см3
