
- •1) Идеальный газ
- •2) Основное уравнение молекулярно-кинетической теории идеального газа
- •Вывод основного уравнения мкт[править | править исходный текст]
- •3) Теорема о равномерном распределении кинетической энергии по степеням свободы. Уравнение состояния идеального газа.
- •Уравнение состояния идеального газа[править | править исходный текст]
- •4) Работа идеального газа. Внутренняя энергия и теплоемкость (молярная и удельная) идеального газа.
- •Адиабатический[править | править исходный текст]
- •Изотермический[править | править исходный текст]
- •Изохорный[править | править исходный текст]
- •Внутренняя энергия идеального газа
- •5) Первый и второй законы термодинамики (различные формулировки). Первый закон термодинамики
- •Частные случаи первого закона термодинамики для изопроцессов
- •Цикл Карно для тепловой машины
- •Эффективность теплового двигателя
- •6) Политропические процессы. Уравнения политропы для идеального газа
- •Уравнения политропы для газа Ван-дер-Ваальса
- •Адиабата Пуассона[править | править исходный текст]
- •Вывод уравнения[править | править исходный текст]
- •8) Циклические процессы. Коэффициент полезного действия и холодильный коэффициент. Циклические процессы
- •9) Цикл Карно. Коэффициент полезного действия и холодильный коэффициент.
2) Основное уравнение молекулярно-кинетической теории идеального газа
![]() .
Основное уравнение МКТ связывает
макроскопические параметры
(давление, объём, температура)
термодинамической системы с
микроскопическими (масса молекул,
средняя скорость их движения).
.
Основное уравнение МКТ связывает
макроскопические параметры
(давление, объём, температура)
термодинамической системы с
микроскопическими (масса молекул,
средняя скорость их движения).
Вывод основного уравнения мкт[править | править исходный текст]
Пусть
имеется ![]() частиц
массой
частиц
массой ![]() в
некотором кубическом сосуде.
в
некотором кубическом сосуде.
Так как молекулы движутся хаотически, то события, состоящие в движении в одном из шести направлений пространства, совпадающих с осями декартовой системы координат, равновероятностны.
Поэтому,
в каждом из этих направлении
движется ![]() частиц.
частиц.
Пусть все
частицы обладают одинаковой скоростью ![]() .
.
Каждая из
частиц, сталкивающихся со стенкой,
передаёт ей импульс ![]() .
.
Если площадь
стенки ![]() ,
а концентрация -
,
а концентрация - ![]() ,
то количество частиц, сталкивающихся
со стенкой за время
,
то количество частиц, сталкивающихся
со стенкой за время ![]() равно
равно ![]() .
.
Так как ![]() ,
а
,
а ![]() -
суммарная сила взаимодействия частиц
со стенкой, то подставив соответствующие
значения получим
-
суммарная сила взаимодействия частиц
со стенкой, то подставив соответствующие
значения получим ![]() ,
,
так как ![]() ,
то
,
то ![]()
3) Теорема о равномерном распределении кинетической энергии по степеням свободы. Уравнение состояния идеального газа.
Теорема о равнораспределении кинетической энергии по степеням свободы, закон равнораспределения, теорема о равнораспределении — связывает температуру системы с её средней энергией вклассической статистической механике. В первоначальном виде теорема утверждала, что при тепловом равновесии энергия разделена одинаково между её различными формами, например, средняя кинетическая энергияпоступательного движения молекулы должна равняться средней кинетической энергии её вращательного движения.
Первоначально термин «равнораспределение» означал, что полная кинетическая энергия системы разделена одинаково среди всех её независимых частей в среднем, как только система достигла теплового равновесия. Теорема о равнораспределении также даёт количественные предсказания для этих энергий. Например, она предсказывает, что каждый атом благородного газа, находящегося в тепловом равновесии при температуре T, обладает средней кинетической энергией поступательного движения равной (3/2)kBT. Как следствие, более тяжёлые атомы ксенона обладают более низкой средней скоростью, чем лёгкие атомы гелия при той же самой температуре. Рисунок показывает распределение Максвелла для скоростей атомов четырёх газов.
В этом примере важно отметить, что кинетическая энергия является квадратичной функцией скорости. Теорема о равнораспределении утверждает, что при тепловом равновесии, любая степень свободы (компоненты векторов положения или скорость частицы)[1], которая появляется только как квадратичная функция в энергии, обладает средней энергией равной ½kBT и поэтому вносит вклад ½kB в теплоёмкость системы. У этого утверждения существует много практических приложений.
Уравнение состояния идеального газа[править | править исходный текст]
См. также: Идеальный газ и Уравнение состояния идеального газа
Теорема о равнораспределении используется для вывода уравнения состояния идеального газа из классической механики.[4]. Формула для средней кинетической энергии на одну частицу, принимая во внимание только три поступательных степени свободы запишется в виде

Если q = (qx, qy, qz) и p = (px, py, pz) обозначают координаты и импульс частицы в газе, а F — сила действующая на эту частицу, тогда
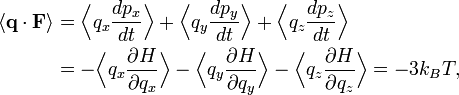
где первое равенство представляет собой второй закон Ньютона, а вторая строчка использует уравнения Гамильтона и равнораспределение. Суммирование по системе из N частиц приводит к выражению
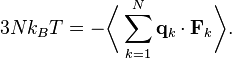
Используя третий закон Ньютона и предположение об идеальности газа, получим полную силу в системе — силу, которая действует со стороны стенок контейнера на систему, и эта сила задаётся давлением P газа. Следовательно
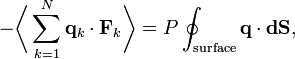
где dS — бесконечно малый элемент площади стенок контейнера. Поскольку дивергенция радиус-вектора q равняется
![]()
то из теоремы о дивергенции получаем
![]()
где dV — бесконечно малый объём внутри контейнера, V — его полный объём.
Собирая уравнения вместе получаем
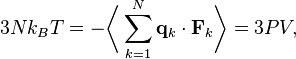
которое приводит к уравнению состояния для идеального газа для N частиц:
![]()
где n=N/NA — число молей газа и R=NAkB — газовая постоянная.[44]
