
- •Федеральное агентство по образованию
- •1. Краткие теоретические сведения
- •1.1.Распределение Больцмана
- •1.2. Барометрическая формула
- •1.3. Диффузия в газах
- •2.Описание экспериментальной установки и методики эксперимента
- •2.1 Соотношение Эйнштейна
- •2.2.Измерение коэффициента диффузии
- •2.3 Распределение Больцмана
- •3. Порядок выполнения работы
- •4. Содержание отчета
- •5. Контрольные вопросы
- •6.Список литературы
1.2. Барометрическая формула
Умножив
обе части распределения
Больцмана
на kT,
получим
согласно основному уравнению МКТ,
что давление
![]() где
где![]() —
молярная масса,R
— универсальная газовая постоянная.
Это так называемая
барометрическая
формула. Она
строго справедлива для идеального
газа, температура которого не зависит
от высоты (изотермическая атмосфера).
На рис. 2 показаны два графика
зависимости давления от высоты z
при разных
температурах
—
молярная масса,R
— универсальная газовая постоянная.
Это так называемая
барометрическая
формула. Она
строго справедлива для идеального
газа, температура которого не зависит
от высоты (изотермическая атмосфера).
На рис. 2 показаны два графика
зависимости давления от высоты z
при разных
температурах
![]() .
Следует
обратить внимание на то, что в отличие
от распределений n(z),
кривые p(z)
на рис. 2 начинаются в одной точке
независимо от температуры. Это не
случайно и имеет простое объяснение .
.
Следует
обратить внимание на то, что в отличие
от распределений n(z),
кривые p(z)
на рис. 2 начинаются в одной точке
независимо от температуры. Это не
случайно и имеет простое объяснение .
 Рассмотрим,
как ведет себя центр масс газа в поле
тяжести. При анализе ситуации, изображенной
на рис. 2, мы приходим к выводу, что в
результате повышения температуры от
Рассмотрим,
как ведет себя центр масс газа в поле
тяжести. При анализе ситуации, изображенной
на рис. 2, мы приходим к выводу, что в
результате повышения температуры от
![]() до
до
![]() центр масс
газа перемещается вверх. Возникает
вопрос: под действием какой внешней
силы? На первый взгляд вроде ничего
не изменилось — ни сила тяжести, ни сила
реакции со стороны поверхности Земли
(ведь давление
центр масс
газа перемещается вверх. Возникает
вопрос: под действием какой внешней
силы? На первый взгляд вроде ничего
не изменилось — ни сила тяжести, ни сила
реакции со стороны поверхности Земли
(ведь давление
![]() осталось прежним).
На самом же деле в процессе нагревания
газа равновесие нарушается
, вторая
сила
оказывается большей
по модулю. Она направлена вверх
и вызывает перемещение центра масс.
осталось прежним).
На самом же деле в процессе нагревания
газа равновесие нарушается
, вторая
сила
оказывается большей
по модулю. Она направлена вверх
и вызывает перемещение центра масс.
Представим
барометрическую формулу в виде
![]() ,
где
,
где![]() —
это высота, на которой давление убывает
в е
раз. Значение h
играет роль характерной толщины
атмосферы. При
—
это высота, на которой давление убывает
в е
раз. Значение h
играет роль характерной толщины
атмосферы. При
![]() =
20 г/моль и Т
=
280 К величина
h
=
8 км. По сравнению
с радиусом
Земли атмосфера — тонкая пленочка
(что и
позволяет при получении барометрической
формулы считать ускорение g
не зависящим
от высоты).
=
20 г/моль и Т
=
280 К величина
h
=
8 км. По сравнению
с радиусом
Земли атмосфера — тонкая пленочка
(что и
позволяет при получении барометрической
формулы считать ускорение g
не зависящим
от высоты).
Из распределения Больцмана возникает следующий «парадокс»: почему в поле тяжести при движении молекул вверх их кинетическая энергия уменьшается, а температура остается прежней, т.е. средняя кинетическая энергия не меняется, а при движении вниз кинетическая энергия всех молекул увеличивается, а средняя их энергия остается той же? Этот «парадокс» был разъяснен уже Максвеллом. При движении вверх молекулы действительно замедляются, но при этом наиболее медленные молекулы выбывают из потока частиц. При движении же вниз, наоборот, молекулы не только ускоряются, но одновременно их поток пополняется более медленными молекулами. В результате средняя скорость теплового движения молекул остается неизменной. Сила тяжести меняет лишь концентрацию молекул на разных высотах, но не температуру газа. И закон распределения Больцмана как раз и выводится из условия, чтобы температура газа оставалась всюду одной и той же.
1.3. Диффузия в газах
Предположим, что в единице объема двухкомпонентной газовой смеси содержится п1 молекул одного вида и п2 молекул другого вида. Полное число молекул в единице объема равно п = п1 + п2. Отношение:
![]()
н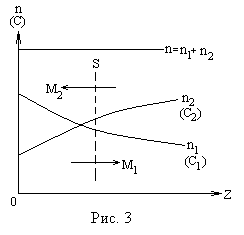 азываетсяотносительной
концентрацией
молекул
i-го
вида.
азываетсяотносительной
концентрацией
молекул
i-го
вида.
Допустим, что в направлении оси Z создаются градиенты концентраций dc1/dz и dc2/dz, причем dc1/dz = — dc2/dz (рис. 3). Тогда
![]()

![]() (3)
(3)
где D — коэффициент пропорциональности, называемый коэффициентом диффузии. Знак минус указывает, что поток молекул направлен в сторону убывания концентрации. Умножив обе части этого равенства на массу молекулы i-го вида mi, получим выражение для потока массы i-й компоненты:
![]() (4)
(4)
где ρi = nimi— парциальная плотность i-й компоненты; ее называют также абсолютной концентрацией.
Формулы (3) и (4) представляют собой эмпирические уравнения диффузии. Их называют также законом Фика.
Получим
уравнение диффузии, основываясь на
молекулярно-кинетических представлениях,
причем для упрощения расчетов будем
считать, что молекулы обеих компонент
мало отличаются по массе (m1
![]() m2
m2
![]() m
) и имеют практически одинаковые
эффективные сечения (σ1
m
) и имеют практически одинаковые
эффективные сечения (σ1
![]() σ2
σ2
![]() σ). В этом случае молекулам обеих компонент
можно приписывать одинаковую среднюю
скорость теплового движения
σ). В этом случае молекулам обеих компонент
можно приписывать одинаковую среднюю
скорость теплового движения![]() ,
а среднюю длину свободного пробега
вычислять по формуле
,
а среднюю длину свободного пробега
вычислять по формуле
![]()
где n = n1 + n2.
Пусть изменение концентрации первой компоненты вдоль оси Z задано функцией n1 = n1 (z).
Ч ерез
поверхностьS
будут пролетать в положительном
направлении оси Z
молекулы, претерпевшие последнее
соударение на различных расстояниях
ерез
поверхностьS
будут пролетать в положительном
направлении оси Z
молекулы, претерпевшие последнее
соударение на различных расстояниях
![]() отS.
Разобьем все пространство слева от S
на слои толщины d
отS.
Разобьем все пространство слева от S
на слои толщины d![]() (рис. 4). Полный поток молекул через
поверхность S
можно получить, просуммировав потоки,
создаваемые молекулами, испытавшими
последнее соударение в таких слоях.
(рис. 4). Полный поток молекул через
поверхность S
можно получить, просуммировав потоки,
создаваемые молекулами, испытавшими
последнее соударение в таких слоях.
Из
слоя толщины d![]() начинают свой полет к поверхностиS
те молекулы первой компоненты, которые
претерпевают в этом слое столкновение
с другими молекулами. Их число равно
начинают свой полет к поверхностиS
те молекулы первой компоненты, которые
претерпевают в этом слое столкновение
с другими молекулами. Их число равно
![]()
где
z
— координата плоскости S
(d![]() /λ
есть вероятность претерпеть соударение
на пути d
/λ
есть вероятность претерпеть соударение
на пути d![]() ).
Эти молекулы создают через поверхностьS
(z
–
).
Эти молекулы создают через поверхностьS
(z
–
![]() ))
поток
))
поток
![]()
Из числа молекул, летящих в этом потоке, достигает поверхности S без столкновений и, следовательно, проникает в пространство, расположенное справа от S, количество молекул, равное
![]() .
.
(е–l/λ
есть вероятность того, что молекула
пролетает путь
![]() без столкновений). Знак «+» приdN1
указывает на то, что имеются в виду
молекулы, летящие в положительном
направлении оси z.
без столкновений). Знак «+» приdN1
указывает на то, что имеются в виду
молекулы, летящие в положительном
направлении оси z.
Полный
поток молекул первой компоненты через
поверхность S
получим, проинтегрировав это выражение
по
![]() :
:
![]()
Воспользовавшись
быстрым спадом экспоненты и малостью
λ,
представим стоящую под знаком
интеграла функцию n1(z
–
![]() )
в виде
)
в виде
![]()
где dn1/dz — производная в точке с координатой z. Тогда

Первый интеграл есть единица, второй равен λ. Следовательно,
![]()
Поток молекул первой компоненты, летящих через поверхность S в отрицательном направлении оси z,
![]()
Результирующий поток молекул первой компоненты через поверхность S в направлении оси z равен разности этих потоков
![]() (5)
(5)
Мы получили уравнение (3), причем коэффициент диффузии
![]() (6)
(6)
При этом коэффициент диффузии для обеих компонент имеет одинаковое значение.
Подставив
в (5) выражения для
![]() и λ, можно получить, что
и λ, можно получить, что
![]()
Коэффициент диффузии оказывается обратно пропорциональным числу молекул в единице объема, а следовательно, и давлению р:
![]()
С
ростом температуры коэффициент диффузии
растет пропорционально
![]()
Так как мы полагали молекулы обеих компонент одинаковыми по массе к эффективному сечению, (6) представляет собой, по существу, выражение для коэффициента самодиффузии, т. е. диффузии молекул некоторого газа в среде молекул того же газа. Явление самодиффузии можно было бы наблюдать, пометив каким-то способом часть молекул однородного газа. Тогда в случае, если бы концентрация меченых молекул и молекул, не несущих отметки, была непостоянна, в газе возникли бы встречные потоки разного рода молекул, причем величина потоков определилась бы формулой (5). Для смеси молекул различной массы и сечения соответствующий расчет дает следующее выражение коэффициента диффузии:
![]()
Здесь
n1,
![]() ,
λ1
— концентрация, средняя скорость и
средняя длина свободного пробега молекул
первого вида,
n2,
,
λ1
— концентрация, средняя скорость и
средняя длина свободного пробега молекул
первого вида,
n2,
![]() , λ2
— те же величины для молекул второго
вида.
, λ2
— те же величины для молекул второго
вида.
