
- •Тема 6. Соединения со смешанными функциями Гидроксиальдегиды и гидроксикетоны. Гидрокси- и оксокислоты
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Гидрокси – и оксоальдегиды и кетоны
- •Оксокислоты
- •Химические свойства
- •2. Кето-енольная таутомерия -оксокислот.
- •Оксокислоты
- •Стереоизомерия
- •(Оптические,
- •Энантиомеры
- •Глоссарий
- •Тема 6. Аминокислоты. Первичная структура белков и пептидов
- •Конкретные задачи
- •Этапы занятия и контроль усвоения знаний.
- •I. Аминокислоты с неполярными (гидрофобными) r-группами (8):
- •II. Аминокислоты с полярными (гидрофильными) незаряженными
- •III. Аминокислоты с полярными (гидрофильными) положительно заряженными радикалами (3):
- •IV. Аминокислоты с полярными (гидрофильными) отрицательно заряженными радикалами (2):
- •Химические свойства аминокислот
- •I. Общие (неспецифические) свойства.
- •Свойства аминов
- •III. Биологически важные реакции - аминокислот
- •2. Реакция декарбоксилирования:
- •IV. Аналитические, качественные реакции аминокислот и пептидов.
- •3. Взаимодействие с 2,4-динитрофторбензолом – днфб (реактивом Сенджера):
- •Глоссарий
- •Тема 8. Углеводы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Тема 8-1. Углеводы. Моносахариды Теория
- •Важнейшие природные моносахариды Альдопентозы
- •Альдогексозы Кетогексоза
- •Перспективные формулы Хеуорса
- •Цикло-цепная таутомерия моносахаридов – это существование в водном растворе смеси таутомерных форм, способных превращаться друг в друга через открытую таутомерную форму:
- •3. Мутаротация сахаров При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
- •4. Конформации моносахаридов
- •5. Эпимеризация
- •6. Химические свойства моносахаридов
- •1. Окисление
- •Галактаровая и др.) кислоты
- •Тема 8-2. Ди – и полисахариды Вопросы для самоподготовки
- •Дисахариды
- •Цикло-цепная таутомерия дисахаридов
- •Химические свойства дисахаридов
- •Реакция «серебряного зеркала»:
- •Полисахариды
- •Тема 9. Гетероциклические соединения
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятий и контроль усвоения знаний
- •Содержание этапов занятия
- •Электронное строение «пиррольного» атома азота
- •Шестичленные гетероциклические системы с одним гетероатомом
- •Электронное строение «пиридинового» атома азота
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Химические свойства
- •Шестичленные гетероциклические соединения с двумя гетероатомами Пиримидин
- •Производные пиримидина
- •Полициклические гетероциклы
- •Триптофан
- •Хинолин и изохинолин
- •Нуклеиновые кислоты
- •Общая схема построения нуклеиновых кислот
- •Нуклеиновые кислоты
- •Нуклеотиды
- •Названия нуклеозидов и нуклеотидов
- •Глоссарий
Содержание этапов занятия
1 этап. Преподаватель проверяет выполнение домашнего задания в рабочих тетрадях и оценивает его по пятибалльной системе.
2 этап. На 1 занятии по теме «Моносахариды» студенты пишут микроконтрольную работу по цикло-цепной таутомерии. На 2 занятии по теме «Ди- и полисахариды» каждый студент отвечает письменно на билет тест-контроля. Билет содержит 2 вопроса:
1-й вопрос – по теме «Моносахариды»;
2-й – по теме «Ди- и полисахариды».
Ответ оценивается по 10 балльной системе (0, 5 или 10 баллов).
3-й этап. На первом занятии по теме «Моносахариды» студенты учатся писать открытые и циклические таутомерные формы моносахаридов на примере глюкозы и фруктозы, разбирают конформационное строение моносахаридов, способствующее образованию 6- и 5- членных циклов (пиранозных и фуранозных форм) и конформации пиранозных форм; анализируют важнейшие химические свойства моносахаридов.
На 2-м занятии по теме «Ди- и полисахариды» разбираются структура, номенклатура, тип и свойства дисахаридов (мальтозы, лактозы, целлобиозы и сахарозы) и полисахаридов (крахмала, гликогена, целлюлозы).
4-й этап. Студенты выполняют лабораторные работы по теме занятия под руководством преподавателя.
5 этап. В ходе выполнения лабораторной работы студенты записывают наблюдения, анализируют их и делают выводы.
6 этап. Защита протоколов лабораторных работ, оценка преподавателем практических навыков, приобретенных студентами на занятии.
Тема 8-1. Углеводы. Моносахариды Теория
Углеводы широко распространены в природе. В организме животных на углеводы приходится до 2 %, а в растениях – до 90 % сухого вещества. Эти вещества выполняют энергетическую, структурную, защитную и другие функции; входят в состав нуклеиновых кислот, коферментов и витаминов; используются в качестве лекарственных препаратов.
В зависимости от строения углеводы классифицируют на моно-, олиго- и полисахариды.
Моносахариды (монозы) – это многоатомные альдегидо- и кетоноспирты, не гидролизующиеся до более простых.
По числу атомов углерода моносахариды подразделяют на тетрозы (С4 ), пентозы (С5), гексозы (С6) и т.д.
Моносахариды, содержащие альдегидную группу, называют альдозами; кетонную – кетозами.
Стереоизомерия моносахаридов
Для представления пространственного строения моносахаридов Э. Фишер предложил использовать проекционные формулы.
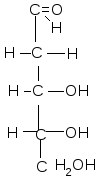
Важнейшие природные моносахариды Альдопентозы

*
*
*
D-рибоза 2–дезокси-D–рибоза D–ксилоза
Альдогексозы Кетогексоза

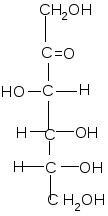

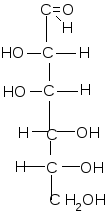
D- глюкоза D-манноза D-галактоза D-фруктоза
Кроме перечисленных выше пентоз и гексоз существуют и их пространственные изомеры, общее число которых вычисляется по формуле N=2n , где n – число асимметрических атомов углерода. Так, число возможных альдопентоз, стереоизомеров D-рибозы, составляет N=23 =8 , т.к. в этой молекуле 3 асимметрических атома углерода (см. формулу выше).
Например:
1.
2. 3.
4. 



D-рибоза L-рибоза D-ксилоза L–ксилоза
1 и 2, 3 и 4 – это энантиомеры; 1 и 3; 1 и 4; 2 и 3; 2 и 4 – диастереомеры.
Напишите формулы недостающих стереоизомеров D–рибозы. Выделите среди них энантио - и диастереомеры. (см. раздел «Стереоизомерия»)
В природе наиболее распространены углеводы D–ряда. Из природных моносахаридов L-ряда выделены: L-арабиноза (свекла), L-рамноза (растительные гликозиды), L-фукоза (пентозаны).
Принадлежность моносахарида к L- или D- ряду определяется по конфигурации его нижнего хирального атома углерода. Эта конфигурация остается без изменения при переходе от эталонного соединения - глицеринового альдегида с помощью оксинитрильного синтеза Килиани–Фишера.

Сравнивая конфигурацию нижнего хирального центра углевода с конфигурацией глицеринового альдегида, определяют стереохимический ряд: L- или D-.

*
*
* *
D-глицериновый D-рибоза
альдегид
Отнесите написанные вами стереоизомеры D–рибозы к D- или L– рядам.
Цикло-цепные таутомеры моносахаридов
По мере изучения свойств моносахаридов выяснилось, что открытые (цепные) формулы не описывают полностью химическое поведение сахаров. Например, несмотря на наличие в молекуле глюкозы пяти ОН– групп, только одна из них вступает в реакцию со спиртами в присутствии сухого хлористого водорода с образованием гликозидов. Для объяснения подобных противоречий было высказано предположение (1870 г. А. Колли; 1883 г. Б. Толленс), что истинное строение моноз не описывается лишь открытой (цепной) формулой. Моносахариды образуют в водном растворе таутомерные смеси открытых и циклических форм. В основе их образования лежит внутримолекулярная реакция нуклеофильного присоединения спиртовых групп к альдегидной или кетонной группе:
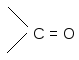
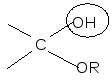
H+ полуацетальный,
+
HOR или
гликозидный





гидроксил

полуацеталь
Такой
реакции способствует клешневидноя
конформация углеродной цепи углевода: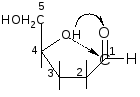
В
1925–30 гг. У. Хеуорс экспериментально
определил размер возможных циклических
таутомеров. Он предложил называть
пятичленные
циклы углеводов фуранозами, а шестичленные
– пиранозами как производные фурана и
пирана,
соответственно:
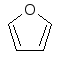
фуран пиран
Пример. Изобразите цикло-цепные таутомеры D-рибозы по Фишеру и Хеуорсу.
Пиранозные формы рибозы образуются путем взаимодействия гидроксильной группы при С5 рибозы с альдегидной группой:



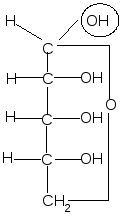

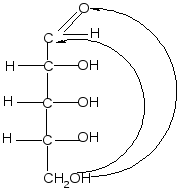
,D–рибопираноза
D–рибоза
,D–рибопираноза
Образование циклической полуацетальной формы приводит к появлению нового хирального центра у первого атома углерода, в результате при такой циклизации получаются два диастереомера, которые отличаются конфигурацией только С1 атома и называются - и -аномерами. В - форме полуацетальный (гликозидный) гидроксил справа от углеродной цепи молекулы; он расположен с той же стороны, что и гидроксил, определяющий принадлежность углевода к D-ряду. В -форме эта группа с противоположной стороны, слева.
Аналогично, только с участием гидроксила при атоме С4, происходит образование фуранозных форм D-рибозы:





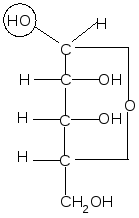

,D–рибофураноза D–рибоза ,D–рибофураноза
