
- •Стерлитамакский филиал
- •7. Э л е к т р о х и м и я в в е д е н и е
- •И с т о р и ч е с к и й о ч е р к
- •7.1 Растворы электролитов
- •7.1.1 Основы теории электролитической диссоциации
- •Причины электролитической диссоциации
- •7.1.2 Теория сильных электролитов дебая и гюккеля
- •7.2.1 Удельная и эквивалентная электропроводности
- •7.2.2 Закон кольрауша
- •7.2.3 Зависимость электропроводности сильных и слабых электролитов от концентрации электролита
- •7.2.4 Подвижность и числа переноса ионов
- •7.2.5 Кондуктометрия
- •7.2.5.1 Измерение электропроводности
- •7.2.5.2 Применение кондуктометрии
- •1.Степень диссоциации электролитов
- •2. Константа диссоциации электролита
- •3.Определение произведения растворимости (пр) труднорастворимых соединений (электролитов).
- •4.Кондуктометрическое титрование
- •5.Электропроводность как метод физико-химического анализа
- •7.3 Электродвижущие силы и равновесные электродные потенциалы
- •7.3.1 Гальванический элемент и электролизер. Законы электролиза
- •7.3.2.1 Термодинамика гальванического элемента
- •7.3.2.2 Определение термодинамических параметров химической реакции
- •7.3.3 Скачки потенциала на границе раздела фаз в электрохимических системах
- •7.3.4 Электродные потенциалы
- •7.3.5 Классификация электродов
- •7.3.6 Водородный электрод
- •7.3.7 Каломельный электрод
- •Потенциал его определяемся соотношением
- •7.3.8 Измерение эдс. Нормальный элемент
- •7.3.9 Концентрационные цепи
- •К цепям второго рода относятся цепи с газовыми или амальгамными электродами.
- •7.3.10 Диффузионные потенциалы
- •7.3.11 Окислительно-восстановительные электроды и цепи
- •7.3.12 Применение потенциометрических методов
- •7.3.13 Стеклянный электрод
- •7.3.14 Потенциометрическое титрование
- •7.4 Неравновесные электрохимические процессы
- •7.4.1 Поляризация
- •7.4.2 Концентрационная поляризация
- •7.4.4 Перенапряжение выделения водорода
- •7.4.5 Полярография
- •Топливные элементы
- •Метода защиты металлов от коррозии
- •8. Химическая кинетика
- •8.1 Скорость химической реакции
- •8.4 Необратимая реакция второго порядка
- •8.5 Обратимая реакция первого порядка
- •А в.
- •8.6 Обратимая реакция второго порядка
- •8.7 Параллельные реакции
- •8.8 Последовательные реакции
- •Подставим выражение в уравнение. Тогда
- •8.9 Методы определения порядка реакции
- •8.10 Влияние температуры на скорость реакции
- •8.11 Теория активных столкновений молекул
- •8.12 Применение теории столкновений к бимолекулярным реакциям. Расчет константы скорости
- •8.13 Бимолекулярный механизм активации мономолекулярной реакции
- •8.14 Теория активного комплекса или переходного состояния
- •8.15 Цепные реакции
- •8.16 Фотохимические реакции
- •8.17 Особенности гетерогенных процессов
- •Растворение твердых тел в жидкостях
- •9. Каталитические реакции
- •9.1 Особенности и классификация каталитических процессов
- •9.2 Гомогенный катализ
- •9.3 Обобщенная теория кислот и оснований. Кислотно-основный катализ
- •9.6 Теории гетерогенного катализа
- •9.6.1 Мультиплетная теория
- •9.6.2 Теория активных ансамблей
- •9.6.3 Электронная теория
- •Содержание
- •7.4 Неравновесные электрохимические процессы
- •8. Химическая кинетика
- •9. Каталитические реакции
- •450062, Г. Уфа, ул. Космонавтов, 1.
- •453118, Г. Стерлитамак, пр. Октября, 2.
7.3.5 Классификация электродов
В основу классификации электродов положено агрегатное состояние и растворимость окисленной и восстановленной формы веществ, участвующих в электродной реакции.
Электроды первого рода
Электродом первого рода называется металл или неметалл, погруженный в раствор, содержащий его ионы.
Примеры: медный электрод в растворе соли меди
Cu2+Cu.
Электроды второго рода
Электрод второго рода состоит из металла, покрытого слоем его малорастворимого соединения и погруженного в раствор растворимой соли, содержащий тот же анион.
Примером служат каломельный и хлорсеребряный электроды:
Cl- Hg2 Cl2, Hg;
Cl- AgCl, Ag.
Газовые электроды
Газовый электрод состоит из инертного металла (обычно платины), контактирующего одновременно с газом и раствором, содержащим ионы этого газообразного вещества.
Примером газовых электродов могут служить водородный, кислородный и хлорный электроды:
Н+ H2, Pt.
Амальгамные электроды
Амальгамный электрод состоит из амальгамы данного металла (раствор металла в ртути) в контакте с раствором, содержащим ионы этого металла:
МеZ+ Me, Hg.
Окислительно-восстановительные электроды
Окислительно-восстановительный электрод состоит из инертного металла, погруженного в раствор, содержащий окисленную и восстановленную форму вещества:
Fe2+, Fe3+ Pt.
7.3.6 Водородный электрод
Этот электрод состоит обычно из платинированной платиновой пластинки опущенной в раствор, содержащий ионы водорода, и омываемый током газообразного водорода. (Платинированием называется покрытие поверхности слоем платиновой черни, т.е. слоем высокодисперсной платины, получаемой обычно электролитическим путем непосредственно на самой пластинке).
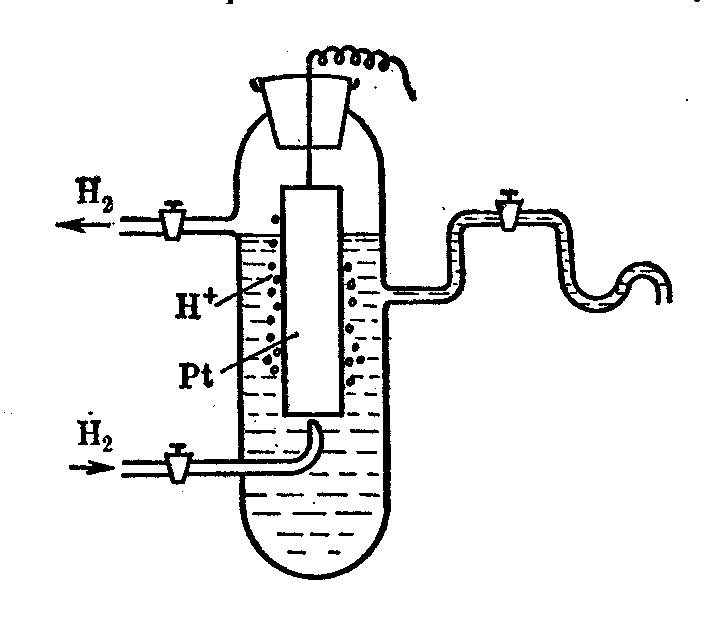
В водородном электроде происходит реакция
1/2Н2 = Н+ + е,
вполне аналогичная реакциям, протекающим на поверхности металлических электродов, обратимых относительно катиона. Платина здесь играет роль только инертного проводника и может быть заменена палладием, иридием, золотом и некоторыми другими металлами.
Электродный потенциал такого электрода зависит от концентрации ионов водорода в растворе, от давления водорода в газовой фазе и от температуры.
Н+ = 0Н+ + (lnaH+ - lnPH2),
для РН2 = 1 атм;
Н+ = lnaH+;
H+ = 1,98410-4 T lgaH+;
H+ = - 1,984 10-4 T (pH) .
Водородный электрод весьма чувствителен к условиям работы. Для получения вполне правильных и устойчивых результатов существенны, в частности, высокая степень чистоты водорода и состояние поверхности платины. При правильной работе, водородный электрод дает очень точные результаты, воспроизводимые до 0,00001 в. Но чувствительность его к условиям процесса сильно усложняет работу с ним. Поэтому обычно пользуются другими электродами, для которых потенциал по отношению к такому электроду известен и которые вместе с тем не так капризны в работе
