
- •Стерлитамакский филиал
- •7. Э л е к т р о х и м и я в в е д е н и е
- •И с т о р и ч е с к и й о ч е р к
- •7.1 Растворы электролитов
- •7.1.1 Основы теории электролитической диссоциации
- •Причины электролитической диссоциации
- •7.1.2 Теория сильных электролитов дебая и гюккеля
- •7.2.1 Удельная и эквивалентная электропроводности
- •7.2.2 Закон кольрауша
- •7.2.3 Зависимость электропроводности сильных и слабых электролитов от концентрации электролита
- •7.2.4 Подвижность и числа переноса ионов
- •7.2.5 Кондуктометрия
- •7.2.5.1 Измерение электропроводности
- •7.2.5.2 Применение кондуктометрии
- •1.Степень диссоциации электролитов
- •2. Константа диссоциации электролита
- •3.Определение произведения растворимости (пр) труднорастворимых соединений (электролитов).
- •4.Кондуктометрическое титрование
- •5.Электропроводность как метод физико-химического анализа
- •7.3 Электродвижущие силы и равновесные электродные потенциалы
- •7.3.1 Гальванический элемент и электролизер. Законы электролиза
- •7.3.2.1 Термодинамика гальванического элемента
- •7.3.2.2 Определение термодинамических параметров химической реакции
- •7.3.3 Скачки потенциала на границе раздела фаз в электрохимических системах
- •7.3.4 Электродные потенциалы
- •7.3.5 Классификация электродов
- •7.3.6 Водородный электрод
- •7.3.7 Каломельный электрод
- •Потенциал его определяемся соотношением
- •7.3.8 Измерение эдс. Нормальный элемент
- •7.3.9 Концентрационные цепи
- •К цепям второго рода относятся цепи с газовыми или амальгамными электродами.
- •7.3.10 Диффузионные потенциалы
- •7.3.11 Окислительно-восстановительные электроды и цепи
- •7.3.12 Применение потенциометрических методов
- •7.3.13 Стеклянный электрод
- •7.3.14 Потенциометрическое титрование
- •7.4 Неравновесные электрохимические процессы
- •7.4.1 Поляризация
- •7.4.2 Концентрационная поляризация
- •7.4.4 Перенапряжение выделения водорода
- •7.4.5 Полярография
- •Топливные элементы
- •Метода защиты металлов от коррозии
- •8. Химическая кинетика
- •8.1 Скорость химической реакции
- •8.4 Необратимая реакция второго порядка
- •8.5 Обратимая реакция первого порядка
- •А в.
- •8.6 Обратимая реакция второго порядка
- •8.7 Параллельные реакции
- •8.8 Последовательные реакции
- •Подставим выражение в уравнение. Тогда
- •8.9 Методы определения порядка реакции
- •8.10 Влияние температуры на скорость реакции
- •8.11 Теория активных столкновений молекул
- •8.12 Применение теории столкновений к бимолекулярным реакциям. Расчет константы скорости
- •8.13 Бимолекулярный механизм активации мономолекулярной реакции
- •8.14 Теория активного комплекса или переходного состояния
- •8.15 Цепные реакции
- •8.16 Фотохимические реакции
- •8.17 Особенности гетерогенных процессов
- •Растворение твердых тел в жидкостях
- •9. Каталитические реакции
- •9.1 Особенности и классификация каталитических процессов
- •9.2 Гомогенный катализ
- •9.3 Обобщенная теория кислот и оснований. Кислотно-основный катализ
- •9.6 Теории гетерогенного катализа
- •9.6.1 Мультиплетная теория
- •9.6.2 Теория активных ансамблей
- •9.6.3 Электронная теория
- •Содержание
- •7.4 Неравновесные электрохимические процессы
- •8. Химическая кинетика
- •9. Каталитические реакции
- •450062, Г. Уфа, ул. Космонавтов, 1.
- •453118, Г. Стерлитамак, пр. Октября, 2.
7.2.4 Подвижность и числа переноса ионов
В растворе электролита ионы движутся беспорядочно. При наложении на раствор электрического поля беспорядочное движение ионов в основном сохраняется, но одно из направлений становится преимущественным. Направленность движения ионов можно создать при помощи электродов, опущенных в раствор. Чем выше градиент потенциала, т.е. чем больше падение напряжения на 1 см раствора электролита вдоль направления электрического поля, тем выше скорость движения иона в электрическом поле Самыми высокими скоростями обладают ионы Н3 О+ и ОН-
Н3О+
+ Н2О
![]() Н2О
+ Н3О+
;
Н2О
+ Н3О+
;
Н2О
+ ОН-
![]() ОН-
+ Н2О.
ОН-
+ Н2О.
Причем средняя продолжительность существования иона Н3О+ =10-11 сек Переносчиками тока в растворах электролитов служат ионы, но так как абсолютные скорости движения анионов и катионов в данном растворе неодинаковы, то большую долю тока всегда переносят более быстрые ионы. Величину, при помощи которой можно выразить долю электричества, переносимую ионами данного вида, называют числом переноса; для катионов оно обозначается t+ и для анионов через t-. Количество электричества, перенесенное ионами i-того вида через данное сечение раствора электролита, определяется по уравнению
qi = ziFCiviS,
где zi_-валентность, Сi- концентрация, vi- абсолютная скорость ионов i -того вида, S - площадь сечения, - время.
Число переноса ti определяется соотношением
ti
=
![]() ,
,
где q - количество электричества, перенесенное всеми ионами. На основании этой формулы можно сказать, что число переноса - это доля электричества, перенесенная ионами данного вида.
В частности, для раствора сильного электролита можно записать
t+
=
![]() ;
;
t-
=
![]() .
.
Подставив предыдущие выражения, получим
t+
=
![]() ;
;
t-
=
![]() ,
,
при этом t+ + t- = 1.
Различие в скоростях движения анионов и катионов приводит к тому, что они переносят разные количества электричества, но это не влечет за собой нарушение электронейтральности раствора, а лишь изменяет концентрацию электролита у катода и анода.
Между числами переноса и подвижностями ионов в растворе сильных электролитов существует зависимость:
из уравнения + = Fv+ ;
- = Fv- следует
t+
=
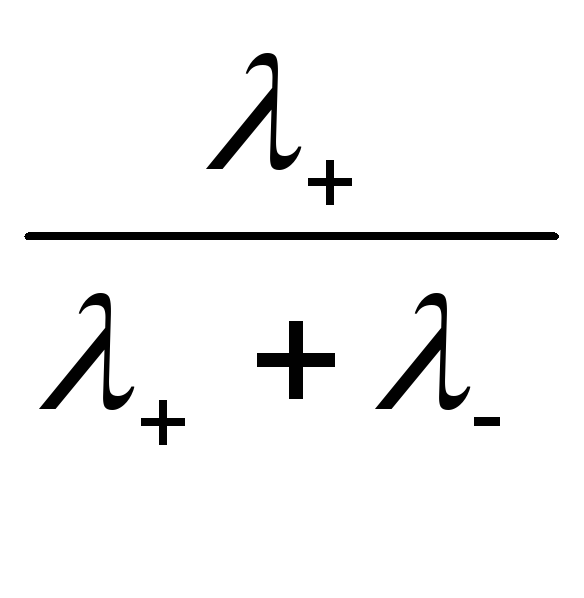 ;
;
t-
=
![]() ;
;
+ = t+ ;
- = t-.
Числа переноса остаются практически постоянными до тех пор, пока концентрация сильного электролита не превышает 0,2 г-экв/л, при дальнейшем увеличении концентрации наблюдается их изменение.
С ростом температуры абсолютные скорости ионов и подвижности ионов увеличиваются, но не в одинаковой мере. Поэтому числа переноса с изменение температуры также меняются. При этом если число переноса катиона увеличивается, то числа переноса анионов уменьшаются и наоборот.
