
- •6. Арены
- •А.И. Кузнецов
- •Оглавление
- •6. Арены
- •Гексагон энергетические
- •Циклопентадиенил анион катион тропилия
- •6.1.1. Нитрование
- •Не очень неустойчивый
- •6.1.2. Сульфирование
- •6.1.3. Галогенирование
- •6.1.4. Алкилирование
- •6.1.5. Ацилирование
- •Пропионилхлорид пропиофенон
- •Применение реакции Фриделя-Крафтса имеет следующие ограничения:
- •6.2. Алкилбензолы
- •6.2.1. Реакции электрофильного замещения толуола
- •6.3. Реакции электрофильного замещения нафталина
- •6.4. Восстановление по Берчу
- •6.5 Окисление аренов
- •Нафталин фталевый ангидрид фталевая кислота
- •6.6. Стирол
- •Фуллерены и нанотрубки
Гексагон энергетические
в цикле уровни МО
Рис.1 Диаграмма относительных уровней энергии -молекулярных орбиталей бензола
Для плоского квадратного циклобутадиена расчет по Хюккелю или использование круга Фроста приводит к тому, что -электроны располагаются на одной связывающей и двух несвязывающих орбиталях.

Рис. 2 Диаграмма относительных уровней энергии -молекулярных
орбиталей циклобутадиена
Рассмотрим, что предсказывает теория Хюккеля для плоского циклооктатетраена, содержащего 8 -электронов. Три -орбитали циклооктатетраена являются связывющими, три разрыхляющими и две несвязывающими. Следовательно, плоский сопряженный циклооктатетраен должен быть бирадикалом. Циклооктатетраен неплоский, потому что он неароматичен.

Рис. 3 Диаграмма относительных уровней энергии -молекулярных
орбиталей циклооктатетраена
Д. Конденсированные ароматические углеводороды
Правило Хюккеля выведено и, строго говоря, применимо для моноциклических систем. Однако некоторые полициклические соединения могут рассматриваться как электронные аналоги аннуленов, в которых общая для двух циклов СС связь жестко закрепляет конфигурацию всей молекулы, что благоприятствует делокализации -электронов. Изображение строения нафталина, антрацена и фенантрена с помощью формул с кругом в центре шестиугольника может привести к недоразумению.



нафталин антрацен фенантрен
Е. Ароматические ионы
Правило Хюккеля применимо не только для циклических, полностью сопряженных полиенов, но и для плоских циклических ионов, содержащих, как и полиены, (4n + 2)-электронов. Оно правильно предсказывает ароматический характер катиона циклопропенилия, двухзарядного катиона циклобутадиенилия (n = 0), аниона циклопентадиена и катиона циклогептатриена (n = 1), дианиона циклооктатетраена и т.д.

Циклопентадиенил анион катион тропилия
Все эти ионы удовлетворяют правилу Хюккеля. Все связывающие орбитали в них заполнены, а все разрыхляющие свободны.
Ж. Ароматические гетероциклические соединения
Гетероциклическими называют соединения, содержащие циклы, включающие один или несколько гетероатомов. Существуют пятичленные, шестичленные и т.д. ароматические гетероциклические соединения. Большинство из них имеют традиционные названия:




пиридин пиррол фуран тиофен



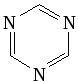
пиримидин имидазол оксазол триазин
Большое значение имеют такие соединения, в которых указанные гетероциклы сконденсированы с другими кольцами.


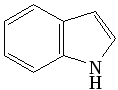

хинолин изохинолин индол бензимидазол
6.1. Электрофильное ароматическое замещение
Характерными реакциями бензола и других аренов являются реакции электрофильного замещения.
А. Механизм электрофильного ароматического замещения
Первоначально атака электрофилом -электронного облака кольца приводит к координации реагента с-системой и образованию комплекса донорно-акцепторного типа, называемого-комплексом. Образование-комплекса является быстрой обратимой стадией, ароматическая система при этом не нарушается:

-комплекс
Чтобы реакция замещения осуществлялась, необходимо преобразование -комплекса в -комплекс. На этой медленной стадии электрофил образует ковалентную связь с атомом углерода за счет двух электронов - системы кольца, что сопровождается переходом данного атома углерода из sp2- в sp3-гибридное состояние и нарушением ароматической системы. Четыре -электрона из ароматической системы распределяются между пятью атомами углерода цикла, а молекула превращается в карбокатион – бензолониевый ион (в общем случае для аренов – аренониевый ион).

-комплекс -комплекс (бензолониевый ион)
В реакциях электрофильного присоединения в ряду алкенов стабилизация -комплекса (карбокатиона) происходила путем присоединения нуклеофила. Но для бензолониевого иона более выгодным является другой путь стабилизации, а именно путь отщепления от -комплекса протона с помощью основания. При этом за счет двух электронов разрывающейся ковалентной связи С—Н восстанавливается замкнутая -система кольца, т.е. происходит возврат молекулы в ароматическое состояние:

В дальнейшем мы будем опускать стадию образования -комплекса и представлять электрофильное ароматическое замещение двухстадийной реакцией присоединения отщепления с промежуточным образованием аренониевого иона, называемого -комплексом.


Такой механизм получил название SE(Ar), т.е. SE (аренониевый).
Б. Влияние заместителей на электрофильное замещение в (правила ориентации)
Существенной особенностью реакций электрофильного замещения является то, что новые заместители вступают в бензольное кольцо в определенные положения по отношению к уже имеющимся заместителям. Закономерности, определяющие направления реакций замещения в бензольном ядре, называются правилами ориентации.
При проведении реакции E+ с ареном, имеющим заместитель, отличаются два эффекта, зависящих лишь от имеющегося заместителя, и не зависящих от реагента. Заместитель может подавать электроны на бензольное кольцо и тем самым облегчать образование -комплекса, или наоборот, т. е. заместитель будет облегчать или затруднять реакцию. Кроме того, он будет ориентировать присоединение электрофила таким образом, чтобы образующийся -комплекс был наиболее стабильным или наименее нестабильным:

сравнительно устойчив очень неустойчив
Ориентирующее влияние заместителей обусловлено их электронными эффектами (статический фактор) и стабильностью промежуточно образующихся аренониевых ионов – -комплексов (динамический фактор).
Статический фактор отражает распределение электроннной плотности в молекуле субстрата. Например в толуоле, где электронодонорная группа СН3 повышает электронную плотность на всех атомах углерода кольца, но особенно в орто- и пара-положениях, т.е. активирует эти положения больше, чем мета-положения. В нитробензоле электроноакцепторная нитрогруппа понижает электронную плотность кольца, причем орто- и пара-положения дезактивируются больше, чем мета-положения.

Динамический фактор, т.е. стабилизирующее или дестабилизирующее влияние заместителя на образующиеся в ходе реакции аренониевые ионы, имеет важнейшее значение. Дезактивирующие заместители дестабилизируют -комплекс и увеличивают энергию активации стадии, приводящей к его образованию. Группы, активирующие бензольное кольцо, стабилизируют -комплекс, снижают его энергию и энергию активации образования -комплекса.
Заместители, подающие электроны на бензольное кольцо и ориентирующие заместитель в орто- и пара-положения называют заместителями I рода. Заместители, оттягивающие электроны с бензольного кольца и ориентирующие заместитель в мета-положение называют заместителями II рода.
К ориентантам I относятся: OH, OR, OCOR, NH2, NHR. NR2, NHCOR, F, Cl, Br, I. К ориентантам II относятся: SO3H, NO2, COOH, COOR, CONH2, CHO, COR, CN, CCl3, CF3.
В дизамещенных производных бензола ориентирующее влияние заместителей будет согласованным, если заместители направляют электрофильный реагент в одни и те же положения кольца. Возможны случаи и несогласованной ориентации, когда ориентирующее влияние одного заместителя не совпадает по направлению с влиянием другого заместителя. При несогласованной ориентации заместители конкурируют между собой, что приводит к образованию смеси продуктов. Но и в этом случае можно предсказать основное направление реакции, руководствуясь следующими обобщениями.
Если в бензольном кольце имеются сильная и слабая активирующие группы, то ориентация в основном определяется сильной группой. Если в бензольном кольце имеются активирующая и дезактивирующая группы, то ориентация электрофильного реагента определяется главным образом активирующей группой.
Атакующий электрофил, как правило, не замещает водород в кольце между двумя заместителями, находящимися в мета-положении относительно друг друга. Атаку электрофила затрудняют стерические препятствия, что ососбенно важно, когда с кольцом связаны объемные заместители.
