
- •6. Арены
- •А.И. Кузнецов
- •Оглавление
- •6. Арены
- •Гексагон энергетические
- •Циклопентадиенил анион катион тропилия
- •6.1.1. Нитрование
- •Не очень неустойчивый
- •6.1.2. Сульфирование
- •6.1.3. Галогенирование
- •6.1.4. Алкилирование
- •6.1.5. Ацилирование
- •Пропионилхлорид пропиофенон
- •Применение реакции Фриделя-Крафтса имеет следующие ограничения:
- •6.2. Алкилбензолы
- •6.2.1. Реакции электрофильного замещения толуола
- •6.3. Реакции электрофильного замещения нафталина
- •6.4. Восстановление по Берчу
- •6.5 Окисление аренов
- •Нафталин фталевый ангидрид фталевая кислота
- •6.6. Стирол
- •Фуллерены и нанотрубки
6.1.5. Ацилирование
В этой реакции, сходной с алкилированием по Фриделю-Крафтсу, ацилгалогенид реагирует с бензолом в присутствии избытка безводного хлорида алюминия. В качестве растворителей при ацилировании обычно используют нитробензол или сероуглерод.
Ацилхлориды получают из карбоновых кислот действием на ни8х SOCl2 или PCl5:


Ацилированием бензола пропионилхлоридом получают пропиофенон:
![]()
 (23)
(23)
Пропионилхлорид пропиофенон
Механизм:

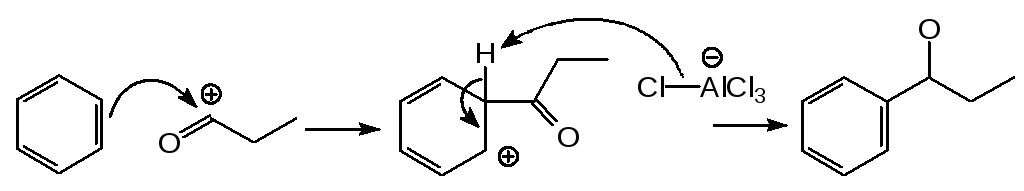
Для получения моноалкиларенов не опасаясь перегруппировок, прибегают к ацилированию с последующим восстановлением карбонильной группы в метиленовую. Одним из методов такого восстановления является реакция Клеменсена. По Клеменсену кетон нагревают в соляной кислоте, содержащей амальгамированный цинк:
 (24)
(24)
пропиофенон пропилбромид
Применение реакции Фриделя-Крафтса имеет следующие ограничения:
1. Реакции алкилирования сопровождаются перегруппировками.
2. Реакции алкилирования сопровождаются образованием полиалкиларенов.
3. В реакцию Фриделя-Крафтса (алкилирования и ацилирования) не вступают соединения, содержащие электроноакцепторные группы.
4. В реакцию Фриделя-Крафтса не вступают арил- и винилгалогениды.
6.2. Алкилбензолы
Алкилбензолы вступают в реакцию радикального хлорирования и бромирования боковой цепи. Эта реакция протекает по цепному механизму, как и радикальное галогенирование алканов, и включает стадии инициирования, роста и обрыва цепи. Для инициирования образования радикальных частиц используется освещение ультрафиолетовым светом (фотолиз) или высокие температуры – 450-500оС (термолиз).
При фотохимическом или термическом хлорировании толуола возможно замещение всех трех атомов водорода, при этом каждый последующий атом замещается труднее предыдущего. Поэтому реакцию можно останавливать на любой стадии.
 (25)
(25)
бензилхлорид дихлорметилбензол трихлорметилбензол
Использование в качестве бромирующего средства бромсукцинимида позволяет осуществлять бензильное бромирование алкиларенов в боковую цепь:
 (26)
(26)
толуол N-бромосукцинимид бензилбромид сукцинимид
 (27)
(27)
этилбензол 1-бром-1-фенилэтанэтан
Алкильные группы, присоединенные к бензольному кольцу, легко окисляются такими окислителями, как дихромат натрия в серной кислоте, оксид хрома (VI) в уксусной кислоте, перманганат калия или азотная кислота. Наиболее часто для окисления боковых цепей используют соединения хрома (VI) и перманганат калия. Конечными продуктами являются ароматические карбоновые кислоты.
 (28)
(28)
толуол бензойная кислота
 (29)
(29)
изопропилбензол бензойная кислота
(кумол)

 (30)
(30)
1,4-диметилбензол 1,4-бензолдикарбоновая кислота
(п-ксилол) (терефталевая кислота)
А. Кумольный метод получения фенола и ацетона
При окислении изопропилбензола (кумола) кислородом воздуха в присутствии солей никеля или кобальта образуется гидропероксид кумола
 (31)
(31)
кумол гидропероксид кумола
При обработке гидропероксида кумола рабавленной серной кислотой он разлагается на фенол и ацетон.
 (32)
(32)
фенол ацетон
