- •Введение в органическую химию Кузнецов а.И.
- •22.09.10
- •Г. Влияние гибридизации 31
- •Введение
- •1 Ковалентная связь
- •Бутан изобутан
- •Пентан изопентан неопентан
- •Пропан бутан изобутан пентан изопентан неопентан
- •1.1 Электроотрицательность и виды связей
- •Связь Разница в Тип связи
- •1.2 Функциональные группы
- •1.3 Углы между связями и форма молекул
- •1.4 Резонанс
- •Основное состояние возбужденное состояние атома углерода
- •2P орбиталей углерода с образованием четырехsp3-гибридных орбиталей.
- •Ао атома углерода и ао четырех атомов водорода.
- •1.7 Делокализованная химическая связь
- •1.8 Взаимное влияние атомов в молекулах и способы его передачи
- •2 Кислоты и основания
- •2.1 Кислоты и основания по Бренстеду-Лоури
- •Б-1 б-2
- •Константы диссоциации и относительная сила кислот и оснований
- •2.3 Положение равновесия в кислотно-основных реакциях
- •2.4 Строение молекулы и кислотность
- •2.5 Кислоты и основания Льюиса
- •2.6 Принцип жестких и мягких кислот и оснований
- •Жесткие и мягкие кислоты и основания
- •Относительная сила кислот и сопряженных им оснований
1.3 Углы между связями и форма молекул
В молекулах на валентных уровнях атомов электроны располагаются парами. Расположение соседних атомов вокруг каждого атома в молекуле обусловливается количеством электронных пар на его внешнем уровне. Во внимание принимаются пары лишь одинарных связей и свободные электронные пары.
Пары электронов отталкиваются друг от друга и поэтому они располагаются так, чтобы уменьшить это отталкивание, что достигается максимально возможным удалением их друг от друга.
Чтобы находиться как можно дальше друг от друга две электронные пары должны располагаться под углом 180о, т.е. находятся на одной прямой по разные стороны от ядра. Линейное строение имеют молекулы диоксида углерода и ацетилена
![]()
![]()
Три пары электронов должны располагаться вокруг центрального атома под углом 120о. Плоское треугольное строение с углом между связями около 120о имеют молекулы этена (этилена) и метаналя (формальдегида) и изоэлектронные им молекулы.



Системы с одинаковым количеством электронных пар у атомов называют изоэлектронными. Изоэлектронные системы имеют сходную геометрию и сходные химические свойства.
Четыре пары электронов должны образовывать между собой угол 109,5 о. Наиболее характерными примерами тетраэдрических структур являются молекулы метана, аммиака и воды.

Электронные пары в аммиаке и воде не равноценны, т. к. свободные электронные пары ближе к ядрам, чем связывающие. Следствием этого является уменьшение валентных углов. В аммиаке он составляет 107,3o, а в воде - 104,5о.
Пять электронных пар располагаются вокруг центрального атома по углам тригональной бипирамиды с двумя типами валентных углов: 90 и 120о. В тригональной бипирамиде аксиальные связи длиннее экваториальных связей. Наиболее характерным примером является пентахлорид фосфора.

Упр. 10. Предскажите валентные углы всех связей в (a) CH3Cl , (б) H2C=CHCl,
(в) CH3-N=C=O, (г) CH3OH, (д) CH3OCH3, (е) CH3NH2, (ж) CH3NH3+, (з) CH3+,
(и) CH3.
Ответ (а) В структуре Льюиса хлорметана (метилхлорида) CH3Cl атом углерода окружен четырьмя регионами электронной плотности. Поэтому мы предсказываем для нее тетрагональное расположение атомов вокруг атома углерода и тетраэдрическую форму молекулы.

(б) В структуре Льюиса винилхлорида H2C=CHCl каждый атом углерода окружен тремя регионами электронной плотности. Поэтому мы предсказываем треугольное расположение атомов вокруг каждого атома углерода и плоскую форму молекулы.

1.4 Резонанс
Имеются молекулы и ионы, для которых можно изобразить не одну, а несколько структур Льюиса. Например, структуру этаноат-иона (ацетат-иона) нельзя описать с помощью только одной классической формулы. Атомы кислорода в ацетат-анионе эквивалентны. Иначе говоря, связи углерода с кислородом этаноат-иона не являются ни простыми, ни двойными. Их кратность представляет собой нечто среднее между простой и двойной связью (на 1/2 простой и на 1/2 двойной). Для описания строения этого аниона следует воспользоваться резонансными структурами.

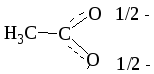
этаноат-ион (ацетат-ион) резонансный гибрид
(эквивалентный вклад каждой структуры)
В отличие от ацетат-иона вклад резонансных структур метаналя (формальдегида) не эквивалентен, т.к. они имеют разный характер.
![]()
Согласно теории резонанса, в тех случаях, когда строение молекулы невозможно с достаточной степенью точности описать одной классической структурой, берут другие возможные для данной молекулы классические структуры, набор которых называется каноническим или резонансным. Наложение друг на друга (суперпозиция) резонансных структур приводит к «резонансному гибриду», который и отражает истинное электронное строение молекулы.
Иначе говоря, если ион или молекула могут быть изображены двумя или более структурами Льюиса, тогда ни одна из этих структур, не является корректным изображением молекулы и ни одна из них не соответствует ни физическим, ни химическим свойствам данной молекулы или иона. Истинное их строение может быть представлено гибридом этих структур.
Обоюдоострая стрелка между резонансными структурами означает не равновесие между ними, а только тот факт, что истинное электронное строение этой молекулы является средним между крайними структурами. Структуры не идентичны, но эквивалентны. Их отличие друг от друга состоит только в расположении электронов. Для того чтобы показать, как оно меняется, используются кривые стрелки.
Резонанс структур ведет к стабилизации основного состояния молекулы, иона или радикала. Мерой этой стабилизации служит энергия резонанса, которая тем больше, чем больше число возможных резонансных структур.
Упр. 11. Изобразите резонансные структуры для следующих молекул и ионов:
(а) (б)
(б)
![]() (в)
(в)

(г) (д)
(д)
 (е)
(е)
![]()
(ж)
![]() (з)
(з)![]() (и)
(и) ![]()
Ответ
(а)
 (б)
(б) ![]() (в)
(в)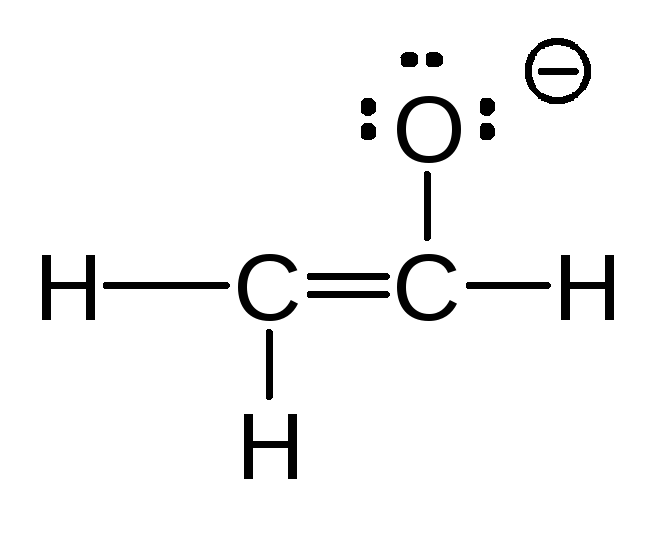 (г) ……
(г) ……
Резонансные структуры могут вносить не одинаковый вклад в гибрид.
Оценить вклад каждой структуры в гибрид можно путем учета ниже следующих факторов.
Структуры, в которых валентные уровни всех атомов насыщены, более предпочтительны, чем те, в которых у одного или двух атомов валентные уровни не насыщены.
Структуры с большим числом ковалентных связей вносят больший вклад, чем структуры с меньшим числом ковалентных связей.
Структуры с разделенными противоположными зарядами вносят меньший
вклад, чем структуры, в которых таких зарядов нет.
Структуры с отрицательным зарядом на более электроотрицательном атоме вносят больший вклад, чем структуры с отрицательным зарядом на менее электроотрицательном атоме.
Упр. 12. Оцените вклад каждой из структур:
(а)
 (б)
(б)

(в)
Ответ (а) Правая структура вносит больший вклад в гибрид потому, что в ней отрицательный заряд находится на более электроотрицательном атоме кислорода. (б) Структуры эквивалентны и вносят одинаковый вклад в гибрид. (в) …
Атомные и молекулярные орбитали
Отрицательно заряженные электроны располагаются вокруг положительно заряженных ядер атомов на орбиталях. Орбиталь s имеет форму шара, а p - гантели. Одна из ветвей гантели имеет положительное значение фазы, а другая - отрицательное.

S орбиталь p орбиталь
Связь между атомами возникает за счет перекрывания атомных орбиталей (АО). Чем больше это перекрывание, тем прочнее связь. Перекрываясь, АО образуют молекулярные орбитали (МО), и вся молекула рассматривается как многоядерная многоэлектронная система, в которой, как в атоме, общие для всей молекулы электроны расселяются по различным МО.
При образовании молекулы водорода из атомов по мере их сближения 1s орбитали начинают перекрываться и АО превращаются в МО молекулы водорода, по которым начинают двигаться оба электрона. На каждой молекулярной орбитали может находиться не более двух электронов и то с разными спинами (принцип Паули). В случае образования молекулы водорода комбинация двух АО дает две МО: связующую, на которой и будут располагаться оба электрона, и разрыхляющую.
![]()
Рис. 1Перекрывание двух АО 1s с образованием связующей МО.
![]()
Рис. 2 Перекрывание двух АО 1s с образованием разрыхляющей МО.
Относительная энергия электрона на связующей МО молекулы водорода значительно меньше энергии на АО атома водорода, в то время как относительная энергия электрона на разрыхляющей МО молекулы водорода значительно больше энергии на АО атома водорода. Энергетическая диаграмма МО молекулы водорода показана на рис..3.

Рис. 3 Энергетическая диаграмма молекулы водорода.
Комбинация двух АО дает две МО.
p-Орбитали могут перекрываться двумя путями. Первый способ перекрывания (рис. 1.4а) осуществляется в том случае, когда оси перекрывающихся орбиталей лежат на одной прямой. При этом перекрывающиеся доли p-орбиталей должны иметь одинаковый знак. Образующаяся в этом случае связь имеет форму эллипса и называется -связью. При втором типе перекрывания (рис. 1.4б) оси p-орбиталей параллельны и образующаяся при этом МО будет состоять из двух частей - над и под плоскостью касания орбиталей. Такая МО по форме напоминает p-орбиталь, ее называют -орбиталью, а соответствующую ей связь – -связью.

Рис. 4. Перекрывание двух АО 2p с образованием связующих а) -МО и б) -МО.
А. Гибридизация атомных орбиталей
Электронная конфигурация валентного слоя атома углерода предполагает его двухвалентность, как, например, в оксиде углерода, однако, в метане, как и в других соединениях, атом углерода образует с другими атомами четыре связи.