
- •21.Термодинамические параметры. Равновесные состояния и процессы. Внутренняя энергия идеального газа. Работа газа при изменении его объема. Количество теплоты. Первый закон термодинамики.
- •Частные случаи первого закона термодинамики для изопроцессов
- •22.Теплоемкость.Теплоемкость идеального газа при постоянном давлении и при постоянном объеме. Уравнение Майера
- •23.Применеие первого закона термодинамики при изохорическом, изобарическом, изотермическом процессах. Адиабатический процесс. Уравнение Пуассона. Работа идеального газа при адиабатическом процессе.
- •24.Второй закон термодинамики. Энтропия. Закон возрастания энтропии. Теорема Нернста. Энтропия идеального газа.
- •Энтропия идеальных газов
- •25. Цикл Карно и его кпд для идеального газа.
- •26. Барометрическая формула. Распределение Больцмана.
- •27. Закон Максвелла распределения молекул по абсолютным значениям скоростей. Средняя, средняя квадратичная и наиболее вероятная скорость молекул.
- •28. Столкновение молекул. Эффективное сечение молекулы. Число столкновений молекулы в единицу времени. Длина свободного пробега молекулы.
- •29.Диффузия в газах. Вязкость газов. Теплопроводность газов. Коэффициенты диффузии, вязкости, теплопроводности. Вывод формулы для коэффициента диффузии.
23.Применеие первого закона термодинамики при изохорическом, изобарическом, изотермическом процессах. Адиабатический процесс. Уравнение Пуассона. Работа идеального газа при адиабатическом процессе.
При изотермическом процессе изменения внутренней энергии в идеальном газе не происходит и все подводимое к газу количество теплоты идет на совершение им работы.
|
При изохорном процессе объем газа остается постоянным. Соответственно, не совершается работа и внутренняя энергия газа изменяется исключительно за счет теплообмена с окружающей средой.
|
(Индекс V означает, что процесс протекает при постоянном объеме).
Если при теплообмене происходит изменение температуры газа на ΔT, то QV = cVmΔT.
cV – удельная теплоемкость газа при постоянном объеме.
Подставляя это выражение в уравнение первого закона термодинамики для изохорного процесса, имеем: ΔU = cVmΔT.
С
другой стороны, для одноатомного
идеального газа 
Приравняв
правые части уравнений и произведя
соответствующие преобразования, имеем: 
При изобарном процессе изменение внутренней энергии газа происходит как за счет теплообмена, так и за счет совершения механической работы. Если к газу подводится некоторое количество теплоты, то оно частично расходуется на увеличение внутренней энергии газа, частично на совершение газом работы при его расширении.
|
(Индекс p означает, что процесс протекает при постоянном давлении).
Давление газа остается постоянным за счет соответствующего изменения объема. Так как ΔU = QV, то Qp = QV + pΔV.
Таким образом оказывается, что для повышения температуры газа на одно и то же количество градусов при постоянном давлении надо сообщить ему большее количество теплоты, чем при постоянном объеме, так часть теплоты расходуется на совершение работы.
Если
обозначить удельную теплоемкость при
постоянном давлении cp,
то первый закон термодинамики для
изобарного процесса примет вид: ![]() или:
или: 
Из
уравнения Менделеева–Клапейрона
следует, что 
Таким
образом, 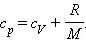
С
учетом того, что 
Наряду с удельными теплоемкостями газа при постоянном объеме и постоянном давлении cV и cp, можно ввести молярные теплоемкости CV = cVM при постоянном объеме и Cp = cpM при постоянном давлении. Сделав это, имеем: Cp = CV + R.
Полученное уравнение носит название уравнения Майера.
Кроме рассмотренных, возможен еще вариант, когда термодинамическая система не обменивается теплотой с окружающей средой. Процесс, происходящий при этом с газом, называется адиабатным. При адиабатном процессе работа совершается газом за счет убыли его внутренней энергии, либо наоборот, за счет совершения над газом работы, увеличивается его внутренняя энергия. Q = 0;A = –ΔU.
Первый закон термодинамики для адиабатического процесса записывается в виде
|
Работа газа в адиабатическом процессе выражается через температуры начального T1 и конечного T2 состояния системы. Для 1 моля газа
|
где CV – молярная теплоемкость газа при постоянном объеме.
Для идеальных газов, чью теплоёмкость можно считать постоянной, в случае квазистатического процесса адиабата имеет простейший вид и определяется уравнением[6][15][16]
![]()
где ![]() —
его объём,
—
его объём, ![]() — показатель
адиабаты,
— показатель
адиабаты, ![]() и
и ![]() — теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
— теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.

![]()
График
адиабаты (жирная линия) на ![]() диаграмме
для газа.
диаграмме
для газа.
![]() —
давление газа;
—
давление газа;![]() —
объём.
—
объём.
С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду
![]()
где ![]() — абсолютная
температура газа.
Или к виду
— абсолютная
температура газа.
Или к виду
![]()
Поскольку ![]() всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении
всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении ![]() )
газ нагревается (
)
газ нагревается (![]() возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент
возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент ![]() .
.
