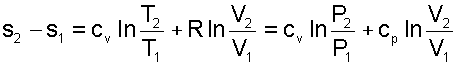- •21.Термодинамические параметры. Равновесные состояния и процессы. Внутренняя энергия идеального газа. Работа газа при изменении его объема. Количество теплоты. Первый закон термодинамики.
- •Частные случаи первого закона термодинамики для изопроцессов
- •22.Теплоемкость.Теплоемкость идеального газа при постоянном давлении и при постоянном объеме. Уравнение Майера
- •23.Применеие первого закона термодинамики при изохорическом, изобарическом, изотермическом процессах. Адиабатический процесс. Уравнение Пуассона. Работа идеального газа при адиабатическом процессе.
- •24.Второй закон термодинамики. Энтропия. Закон возрастания энтропии. Теорема Нернста. Энтропия идеального газа.
- •Энтропия идеальных газов
- •25. Цикл Карно и его кпд для идеального газа.
- •26. Барометрическая формула. Распределение Больцмана.
- •27. Закон Максвелла распределения молекул по абсолютным значениям скоростей. Средняя, средняя квадратичная и наиболее вероятная скорость молекул.
- •28. Столкновение молекул. Эффективное сечение молекулы. Число столкновений молекулы в единицу времени. Длина свободного пробега молекулы.
- •29.Диффузия в газах. Вязкость газов. Теплопроводность газов. Коэффициенты диффузии, вязкости, теплопроводности. Вывод формулы для коэффициента диффузии.
24.Второй закон термодинамики. Энтропия. Закон возрастания энтропии. Теорема Нернста. Энтропия идеального газа.
Второе начало термодинамики имеет несколько формулировок. Формулировка Клаузиуса:невозможен процесс перехода теплоты от тела с более низкой температурой к телу с более высокой.
Формулировка Томсона: невозможен процесс, результатом которого было бы совершение работы за счет теплоты, взятой от одного какого-то тела. Эта формулировка накладывает ограничение на превращение внутренней энергии в механическую. Невозможно построить машину (вечный двигатель второго рода), которая совершала бы работу только за счет получения теплоты из окружающей среды.
Формулировка Больцмана: Энтропия — это показатель неупорядоченности системы. Чем выше энтропия, тем хаотичнее движение материальных частиц, составляющих систему. Давайте посмотрим, как она работает, на примере воды. В жидком состоянии вода представляет собой довольно неупорядоченную структуру, поскольку молекулы свободно перемещаются друг относительно друга, и пространственная ориентация у них может быть произвольной. Другое дело лед — в нем молекулы воды упорядочены, будучи включенными в кристаллическую решетку. Формулировка второго начала термодинамики Больцмана, условно говоря, гласит, что лед, растаяв и превратившись в воду (процесс, сопровождающийся снижением степени упорядоченности и повышением энтропии) сам по себе никогда из воды не возродится.Энтропия не может уменьшаться в замкнутых системах — то есть, в системах, не получающих внешней энергетической подпитки.
Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю. Является одним из постулатов термодинамики, принимаемым на основе обобщения значительного количества экспериментальных данных.
Третье начало термодинамики может быть сформулировано так:
«Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система».
![]()
или

где ![]() —
любой термодинамический параметр.
—
любой термодинамический параметр.
Третье начало термодинамики относится только к равновесным состояниям.
Поскольку на основе второго начала термодинамики энтропию можно определить только с точностью до произвольной аддитивной постоянной (то есть, определяется не сама энтропия, а только её изменение):
![]() ,
,
третье начало термодинамики может быть использовано для точного определения энтропии. При этом энтропию равновесной системы при абсолютном нуле температуры считают равной нулю.
Энтропия идеальных газов
Для получения рассчетного выражения изменения энтропии идеальных газов воспользуемся первым законом термодинамики, в котором теплота определяется с использованием изменения энтальпии
|
|
(4.58) |
Для идеального газа изменение энтальпии определяется как dh=cPdT, а удельный объем v=RT/P. Подставив данные выражения изменения энталпии и удельного объема в уравнение (4.58), получим уравнение для изменения энтропии идеального газа
|
|
(4.59) |
Разность энтропий идеального газа в конкретных двух состояниях можно получить интегрированием выражения (4.59)
|
|
(4.60) |
Воспользовавшись формулой Майера сР=сV+R и уравнением Менделеева-Клапейрона Pv=RT, выражение (4.60) можно записать и через две другие пары термических параметров состояния
|
|
(4.61) |
Для определения абсолюного значения энтропии идеального газа необходимо зафиксировать начало ее отсчета любой парой термических параметров состояния. Например, приняв s0=0 при Т0 и Р0, воспользовавшись уравнением (4.60), получим
|
|
(4.62) |
Выражение (4.62) свидетельствует о том, что энтропия идеального газа есть параметр состояния, поскольку ее можно определить через любую пару параметров состояния. В свою очередь, поскольку энтропия сама является параметром состояния, используя ее в паре с любым независимым параметром состояния, можно определить любой другой параметр состояния газа.