
- •Лабораторный практикум по общей химии Издание третье, дополненное
- •Рецензенты д.Х.Н. Проф. Кафедры общей химии мгу им.. Ломоносова о. С. Зайцев и к.Х.Н. Доц. Кафедры промышленной экологии ргу нефти и газа г. И. Журавлев.
- •Введение
- •Порядок работы в химической лаборатории.
- •Лабораторная работа № 1. Важнейшие классы неорганических соединений
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения
- •III. Экспериментальная часть.
- •Лабораторная работа № 2 определение молярной массы эквивалента металла.
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть. Определение молярной массы эквивалента магния.
- •Лабораторная работа № 3 приготовление растворов заданной концентрации
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть
- •Опыт 1 Приготовление растворов солей из безводных веществ
- •Лабораторная работа № 4 химическая кинтика и химическое равновесие. Катализ
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть.
- •Лабораторная работа № 5 электролитическая диссоциация.
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть.
- •Лабораторная работа № 6 гидролиз
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II . Вопросы и упражнения
- •III. Экспериментальная часть.
- •Лабораторная работа № 7 условия выпадения и растворния осадков
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть.
- •Лабораторная работа № 8 комплексные соединения.
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II Вопросы и упражнения.
- •III. Экспериментальная часть.
- •3А. Сульфат тетраамминмеди (II).
- •Ацидокомплексы.
- •4А. Тетраиодовисмутат калия.
- •4Б. Тетраиодомеркурат калия.
- •4В. Гидроксосоли.
- •Лабораторная работа № 9 окислительно-восстановительные реакции.
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть. Межмолекулярные окислительно-восстановительные реакции
- •2А. Взаимодействие металлов с хлороводородной и разбавленной серной
- •2Б. Взаимодействие металлов с кислотами-окислителями. Взаимодействие меди и железа с концентрированной серной кислотой.
- •Взаимодействие меди и железа с разбавленной и концентрированной азотной кислотой.
- •2В. Взаимодействие амфотерного металла с раствором щелочи.
- •2Г. Взаимодействие металлов с растворами солей.
- •6А. Термическое разложение бихромата аммония.
- •6Б* Термическое разложение нитрата калия.
- •Лабораторная работа № 10 химические свойства металлов и их соединений
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения для подготовки к лабораторной работе.
- •III. Экспериментальная часть.
- •Жесткость воды
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения
- •III Экспериментальная часть
- •II. Вопросы и упражнения для подготовки к лабораторной работе.
- •III. Экспериментальная часть. Алюминий и его соединения
- •Металлы побочных подгрупп (d-металлы)
- •II. Вопросы и упражнения для подготовки к лабораторной работе.
- •III. Экспериментальная часть. Железо и его соединения
- •Цинк и его соединения
- •Медь и ее соединения
- •Лабораторная работа № 12 химические свойства неметаллов и их соединений
- •I. Разделы курса, необходимые для подготовки к лабораторной работе
- •Соединения углерода (IV)
- •II. Вопросы и упражнения
- •III. Экспериментальная часть.
- •Химические свойства соединений азота
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть. Опыт 1.Свойства аммиака
- •Химические свойства пероксида водорода.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть.
- •Химические свойства серы и ее соединений
- •II. Вопросы и упражнения
- •III. Экспериментальая часть. Реакции s2-
- •Реакции s0
- •II. Вопросы и упражнения для подготовки к лабораторной работе.
- •Ш. Экспериментальная часть.
- •Лабораторная работа № 12 электродные потенциалы
- •I. Разделы теоретического курса для подготовки к лабораторной работе.
- •II. Вопросы и упражнения
- •III. Экспериментальная часть
- •IV. Вопросы и упражнения для защиты лабораторной работы
- •Лабораторная работа № 13 электрохимическая коррозия металлов.
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть
- •3А) Пассивация железа в концентрированной азотной кислоте
- •3Б) Активация алюминия в растворе соляной кислоты
- •Оглавление
Лабораторная работа № 12 электродные потенциалы
I. Разделы теоретического курса для подготовки к лабораторной работе.
Особенности химической связи в металле. Возникновение скачка потенциала на границе раздела: металл-электролит. Анодный и катодный процессы. Электродный потенциал. Стандартный электродный потенциал. Ряд стандартных электродных потенциалов и ряд активностей металлов. Гальванический элемент. Равновесный (обратимый) электродный потенциал. Уравнение Нернста. Концентрационный элемент. Неравновесный (необратимый) электродный потенциал. Представление о коррозионном процессе.
II. Вопросы и упражнения
1. Почему растворение металла в электролите связано с процессом окисления?
2. Что такое электродный потенциал? Какой: термодинамической или кинетической характеристикой системы «металл – электролит» он является?
3. Что такое «анодный процесс»? Напишите уравнения анодного процесса при растворении а) меди, б) цинка, в) серебра.
4. Что такое «катодный процесс»? Напишите уравнения катодного процесса при контакте а) меди с раствором сульфата меди, б) цинка с раствором хлорида цинка, в) серебра раствором нитрата серебра.
5. Что такое «стандартный электродный потенциал»? Почему ряд стандартных электродных потенциалов тождественен ряду активностей металлов?
6. Какой металл является анодом и какой катодом в гальванических элементах а) Zn/Zn(NO3)2 // AgNO3/Ag; б) Mg/MgSO4 // CuSO4/Cu? В каком направлении будут перемещаться электроны во внешней цепи каждого из этих элементов? Напишите уравнения электродных процессов, превалирующих на каждом из элементов.
7. Вычислите значение электродного потенциала серебра в растворе нитрата серебра с активностью собственных ионов 10-5 моль/л.
8. Гальванический элемент составлен из стандартного цинкового электрода и хромового электрода, погруженных в раствор , содержащий ионы Cr+3 . При какой концентрации ионов хрома ЭДС этого элемента будет равна нулю?
9. Чем отличается равновесный (обратимый) потенциал металла от неравновесного (необратимого)? Напишите уравнения анодного и катодного процессов при растворении цинка а) в растворе нитрата цинка; б) в растворе соляной кислоты, г) в растворе хлорида натрия.
III. Экспериментальная часть
Приборы и реактивы. Потенциометр, электролитические ячейки, стакан на 50 мл, хлорсеребряный электрод сравнения, рабочие электроды: цинковый, медный и железный. Растворы хлорида калия (1М), соли железа (II), сульфата меди и сульфата цинка (1 М, 10-1 М, 10-2 М, 10-3 М), раствор гексацианоферрата (III) калия.
Рис. 1 Схема установки для измерения потенциала.
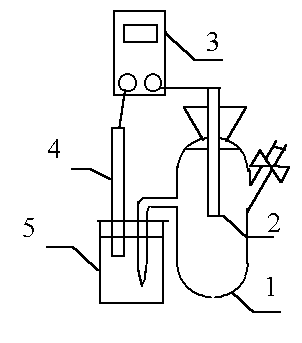
1 - электрохимическая ячейка с электролитом;
2 – исследуемый металл (рабочий электрод);
3 – потенциометр;
4 – электрод сравнения;
5 – стаканчик с раствором хлорида калия
Рис.2 Схема химического гальванического элемента
1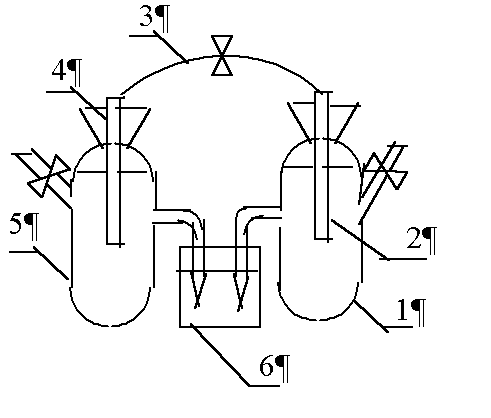 – электрохимическая ячейка с раствором
хлорида калия; 2 – железный электрод;
– электрохимическая ячейка с раствором
хлорида калия; 2 – железный электрод;
3 соединительный провод; 4 – цинковый (медный) электрод; 5 – ячейка с раствором сульфата цинка (сульфата меди);
6 – стаканчик с раствором хлорида калия
Выполнение работы.
Опыт 1. Изучение характера поведения металла при работе гальванических элементов.
1а) Стержень цинкового электрода зачистите наждачной бумагой, промойте водой и высушите фильтровальной бумагой. Вставьте стержень электрода в одну из ячеек и заполните ее 1М раствором сульфата цинка таким образом, чтобы в носике ячейки не осталось пузырьков воздуха. В небольшой химический стакан налейте раствор хлорида калия. Установите ячейку в штативе рядом со стаканчиком с хлоридом калия, погрузив носик ячейки в раствор KCl (рис.1). В этот же стаканчик погрузите носик хлорсеребряного электрода сравнения. Подключите электрод сравнения и рабочий электрод к потенциометру и через 3 - 5 минут после подключения определите потенциал цинкового электрода по отношению к хлорсеребряному электроду сравнения.
Действуя аналогично, определите потенциалы железного электрода в 3% растворе хлорида калия и медного электрода в 1М растворе сульфата меди. Какой металл выступает в роли анода, а какой – в роли катода в каждом из опытов?
Напишите уравнения полуреакций, проходящих на аноде и катоде в этих опытах.
1б) Составьте гальванический элемент из цинкового электрода в растворе своей соли и железного электрода в растворе хлорида натрия, соединив между собой их клеммы (рис. 2). Дайте элементу поработать 10 - 15 минут, после чего разберите элемент. Из ячейки, где находился железный электрод, перелейте часть электролита (около 5 мл) в стаканчик. Добавьте туда же 1 микрошпатель сухой соли гексацианоферрата (III) калия. Что наблюдается?
Повторите эксперимент, предварительно тщательно зачистив железный электрод и ополоснув дистиллированной водой и залив в ячейку свежий раствор хлорида натрия, а цинковый электрод заменив на медный, опущенный в раствор своей соли. Дайте элементу поработать 10 - 15 минут, после чего разберите элемент. Из ячейки, где находился железный электрод, перелейте часть электролита (около 5 мл) в стаканчик. Добавьте туда же 1 микрошпатель сухой соли гексацианоферрата (III) калия. Что наблюдается в новом эксперименте?
Чем вы можете объяснить, что эффекты, которые вы наблюдали при добавлении раствора гексацианоферрата (III) калия в первом и во втором случае, не совпадали?
Какой металл выступает в роли анода, а какой – в роли катода в каждом из опытов? Напишите уравнения полуреакций, проходящих на аноде и катоде в обоих экспериментах.
Опыт 2. Определение природы электродных потенциалов некоторых металлов и прогнозирование их поведения в растворах электролитов.
Пользуясь методикой, описанной выше, определите потенциалы меди в растворах сульфата меди с концентрацией 1М,. 10-1М,. 10-2М, 10-3М, начиная с наиболее разбавленного раствора . В качестве электрода сравнения используйте хлорсеребряный электрод. Определите потенциалы железа в растворах соли железа (II) концентрацией 1М,. 10-1М,. 10-2М, 10-3М по отношению к хлорсеребряному электроду. Все полученные значения занесите в таблицу.
Переведите значения потенциалов металлов, определенных по отношению к хлорсеребряному электроду (Еэксп. ХСЭ), в потенциал металла, определенный по отношению к нормальному водородному электроду (Еэксп.НВЭ).
Пользуясь данными табл.12 Приложения, определите активность ионов металла в каждом из рабочих растворов и полученные значения внесите в таблицу. Для вычисления значения активности ионов в растворе используйте формулу:
aMe = cMe ……….(1)
где: aMe – активность ионов металла, моль/л;
cMe - концентрация ионов металла, моль/л;
- коэффициент активности соли (см. табл. 12 Приложения).
Пользуясь уравнением Нернста, определите значение равновесного потенциала меди и железа в каждом из растворов.
E (Me/Me+n)= E0 (Me/Me+n)+ (RT/nF) ln a(Me+n) ………(2)
где: E (Me/Me+n) - равновесный потенциал металла, В
E0 (Me/Me+n) - стандартный потенциал металла, В
R - универсальная газовая постоянная, R=8,31 Дж/мольК
T – абсолютная температура эксперимента, К
n – число электронов, принимающих участие в реакции окисления
металла
F – постоянная Фарадея, F = 96500 Кулон
a (Ме+n) – активность ионов металла в растворе электролита
Для обычной при электрохимических измерениях температуры (250С = 298 К), после подстановки численных значений постоянных уравнение Нернста принимает вид:
E (Me/Me+n)= E0 (Me/Me+n) + (0,059/n) lg a (Me+n)……….(3)
Полученные результаты внесите в таблицу (Ерасч.).
Таблица. Данные для идентификации природы электродного потенциала:
|
Концен-трация электро- лита, моль/л |
Рабочий электрод | |||||||
|
Cu2+/ Cu |
Fe2+/ Fe | |||||||
|
Актив-ность ионов Cu2+, моль/л |
Ерасч, В |
Еэкс/ХС'Э, В |
Еэкс/НВЭ, В |
Актив-ность ионов Fe2+, моль/л |
Ерасч, В |
Еэкс/ХСЗ, В |
Еэкс/НВЭ, В | |
|
1 |
|
|
|
|
|
|
|
|
|
10-1 |
|
|
|
|
|
|
|
|
|
10-2 |
|
|
|
|
|
|
|
|
|
10-3 |
|
|
|
|
|
|
|
|
Постройте на миллиметровой бумаге отдельно для меди и для железа зависимости а) экспериментально полученных значений потенциала металла по отношению к НВЭ от lg CM ионов металла в растворе электролита,
б) значений потенциала, полученных расчетным путем по уравнению Нернста, от lg CM ионов металла в растворе электролита. Сопоставьте полученные зависимости. Сделайте вывод относительно природы измеренных потенциалов ( равновесный или неравновесный потенциал) меди и железа, находящихся в растворах своих солей разной концентрации.
