
Билет 10
.docx
Билет № 10
Для описания химической связи используют 2 метода:
-Метод валентных связей (Метод ВС)
-Метод молекулярных орбиталей (Метод МО)
Основные положения метода ВС:
-
Единичную химическую связь образуют 2 электрона с антипараллельными спинами.
-
Валентность (ковалентность) равна числу неспаренных электронов данного атома, находящегося в периферических слоях элемента в стационарном и возбужденном состояниях.
-
Ковалентная связь тем прочнее, чем больше перекрывание электронных облаков.
-
Химическая связь располагается в том направлении, в котором достигается наибольшее перекрывание валентных орбиталей.
Основные положения метода МО:
-
Молекула рассматривается как совокупность ядер и электронов, где каждый электрон движется в поле остальных электронов и всех ядер.
-
Состояние электрона описывается волновой функцией ф, которая характеризуется определенным набором квантовых чисел.
-
Ф-молекулярная орбиталь,(МО),в отличие от одноцентровой атомной орбитали молекулярная орбиталь многоцентровая.
-
Как и для электрона в атоме, квадрат модуля волновой функции определяет плотность вероятности нахождения электрона или плотность электронного облака.
-
Каждой МО соответствует определенная энергия занятых электронов.
-
Совокупность МО молекулы -электронная конфигурация молекулы.
Основные характеристики ковалентной связи:
-
Энергия связи - энергия ,которая выделяется при образовании химической связи.
-
Длина связи - расстояние между ядрами взаимодействующих атомов. Чем > связи, тем <энергия связи.
-
Направленность обуславливает пространственное строение молекул.
-
Кратность ковалентной связи - число общих электронных пар, участвующие в образовании связи.
-
Ковалентная связь образуется за счет перекрывания валентных электронных облаков, имеющих различную форму, поэтому их взаимное перекрывание может осуществляться различными способами:
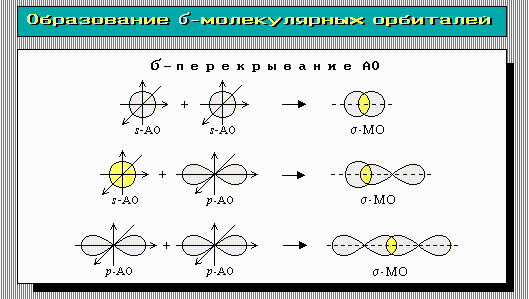
σ и π-связи:
σ-связь- это связь, в которой перекрывание атомных орбиталей происходит вдоль оси, связывающей ядра атомов.
Сигма связь может образовываться всеми типами орбиталей :
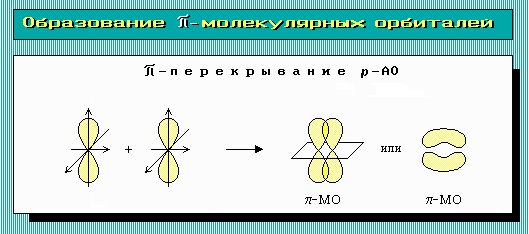
π-связь возникает при перекрывании электронных облаков по обе стороны от линии, соединяющей центры взаимодействующих атомов:
Представления о направленности ковалентной связи позволяет объяснить формы молекул:
Например, при образовании молекулы HCL область перекрывания электронных облаков находится на линии, соединяющей центры взаимодействующих атомов, поэтому молекула имеет линейное строение.
При образовании молекулы H2O 2 неспаренные p-орбитали атома O2
,расположенные по оси x и y, перекрываются с s-электронными облаками 2-х атом.H2.поэтому молекула имеет угловое строение.
 а
а
NH3-пирамидальное строение,т ,к N использует 3p-орбитали,
расположенные по оси x.y.z.

Форма молекул зависит от гибридизации атомных орбиталей,участвующих в образовании связи.
Поясним на конкретных примерах. В молекуле BeCl2 есть две связи Be—Cl. Форма этой молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах располагались как можно дальше друг от друга:
![]()
Это возможно только при линейной форме молекулы, когда угол между связями (угол ClBeCl) равен 180о.(sp-гибридизация)
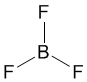
Другой пример: в молекуле BF3 имеется 3 связи B—F. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника, где все углы между связями (углы FBF) равны 120о :(sp2-гибридизация)
Еще один пример: в молекуле CH4 имеется 4 связи C—H. Все эти 4 связи расположатся максимально далеко друг от друга только тогда, когда молекула примет форму тетраэдра, у которого в центре находится атом C, а в вершинах - атомы H. Кстати, в "квадратной" молекуле расстояние между атомами водорода было бы меньше, поэтому реальная молекула CH4 имеет форму тетраэдра:
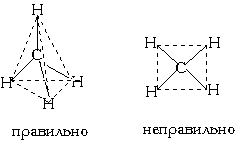
В молекуле CH4 угол НСН такой же, как в математическом тетраэдре: 109о28’.(sp3-гибридизация)
