
Комплексные соединения.(31)
.docxБИЛЕТ №31
Комплексные соединения. Характер химической связи в комплексных соединениях. Понятие о комплексообразователе, лигандах, координационном числе. Внутренняя и внешняя сферы. Номенклатура комплексных соединений.
Метод валентных связей был крупным шагом на пути создания теории химической связи, однако он имеет ограниченный круг применения, т.к. существует огромное количество веществ, в которых атомы проявляют переменные валентности. Примером таких веществ являются комплексные соединения.
К концу XIX века открыто много химических веществ, которые имели возможность вступать во взаимодействие с другими веществами с образованием новых молекул II порядка.
Ученый Вернер первым предложил отказаться от представлений о постоянной валентности. Он первым создал координационную теорию или теорию комплексных соединений, основными положениями которой является:
-
помимо главных валентностей у атомов могут существовать и побочные;
-
насыщение главных валентностей приводит к образованию соединений I порядка, например HCl, H2O, AlCl3 и т.д.
-
насыщение побочных валентностей приводит к образованию соединений II порядка, которые являются продуктами соединений I порядка;
Согласно современным представлениям комплексным является любое соединение, в составе которого имеется хотя бы одна ковалентная связь, образованная по донорно-акцепторному механизму.
Современная наука считает, что КС состоит из центрального атома или иона-комплексона и окружающих его лигандов. Центральный атом и лиганды образуются внутреннюю координационную сферу. Большинство КС имеет и внешнюю координационную сферу. Центральный атом или ион координирует лиганды, геометрически правильно располагая их в пространстве. Число лигандов определяется координационным числом. В качестве лигандов могут быть либо нейтральные молекулы, либо ионы. Внешняя координационная сфера состоит из ионов, непосредственно не связанных с центральным атомом.
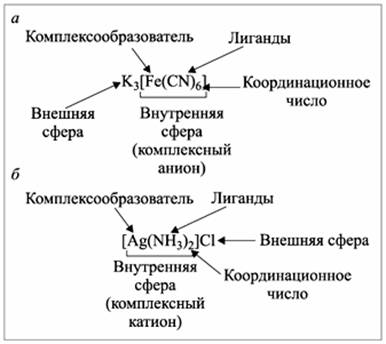
Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователей и общего заряда лигандов. Если лиганды нейтральные молекулы, то заряд внутренней координационной сферы равен заряду комплексообразователя.
В природе известны КС, состоящие только из центрального атома и лигандов и не имеющие внешней координационной сферы. Например, [Pt(NH3)4Cl2], карбонилы металлов [Co(CO)4].
Подобного типа соединения являются неэлектролитами, в водных растворах не диссоциируют на ионы. Если рассмотреть способность к комплексообразованию различных атомов, можно отметить, что наиболее устойчивые КС образуют атомы d-элементов. Меньшей способностью к комплексообразованию обладают p-элементы. У s-элементов эта способность крайне мала. Это объясняется тем, что атомы d-элементов имеют большое количество свободных валентных орбиталей, которые они могут предоставлять другим атомам для образования новой связи по донорно-акцепторному механизму.
Наиболее важными в биологическом плане являются КС, образованные такими представителями d-элементов, как Co, Ni, Fe, Mn, Zn, Cu – входят в состав ферментов.
Природа химических связей в КС.
Рассмотрим такое КС, как тетрааммин меди II [Cu(NH3)4]2+
+29
Cu 1s2
2s2
2p6
3s2
3p6
4s1
3d10
-
2
…4s0
3d9
…4s0
3d9
Cu2+ является радикалом; имеет 1 неспаренный электрон, что подтверждается его магнитными свойствами. Кроме этого ион меди имеет много свободных орбиталей 4s, 4p, 4f. При взаимодействии с лигандами (молекулами NH3) часть из этих орбиталей подвергается гибридизации. При этом гибридизации подвергаются 1s и 3p орбитали => sp3-гибридизация, которая располагается под углом 10928’ (тетраэдр).
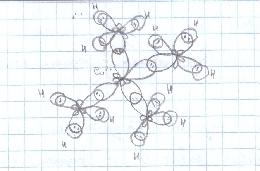
NH3 +7 1s2 2s2 2p3
 В
молекуле NH3
орбитали
атома N
подвергаются sp3-гибридизации,
при этом образуются H
гибридные орбитали, 3 из которых имеют
по одному неспаренному электрону, одна
– имеет готовую пару электронов.
В
молекуле NH3
орбитали
атома N
подвергаются sp3-гибридизации,
при этом образуются H
гибридные орбитали, 3 из которых имеют
по одному неспаренному электрону, одна
– имеет готовую пару электронов.
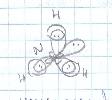
Каждая неиспользованная орбиталь атома азота, имеющая пару электронов, перекрывается с гибридной sp3-орбиталью иона меди, которая не имеет электронов. При этом неподеленная пара N обобществляется.
Ориентация связи металл-лиганды определяет пространственную конфигурацию комплексных молекул и ионов.
Например, в ионах [Cu(NH3)4]2+ можно предполагать, что лиганды будут находиться в вершинах тетраэдра. Однако близкое расположение двух неспаренных электронов друг к другу трансформирует тетраэдрическую форму в квадрат.
NH3
NH3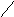
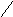



Cu2+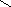


NH3
NH3
Связи
лежат в одной плоскости.
КС подобного типа называются квадратными.
Если координационное число равно 6, то форма иона – октоэдрическая.
Если координационное число равно 2, то форма иона – линейная.
Если лиганды присоединяются к центральному атому не одной, а двумя и более донорно-акцепторными связями, то лиганд имеет координационную емкость или дентатность. Она может быть би-/три- и т.д.
Лиганды NH3, H2O, ионы галогенов – всегда монодентатные.
SO42-, CO32- и др. – бидентатные.
Среди органических соединений известны три, тетра и более дентатные лиганды.
Связь между комплексным ионом и внешней координационной сферой образуется за счет электростатического притяжения ионов, т.е. связь является ионной.
Классификация КС.
Если взять за основу классификации КС заряд внутренней координационной сферы, то все КС делят на 2 группы:
-
катионные; [Cu(NH3)4]SO4
-
анионные; K3[Fe(OH)6]
Если за основу классификации взять тип лиганда, образующего комплексный ион, то КС делят на:
-
КС, в которых в качестве лигандов испрльзуются нейтральные молекулы. Среди них можно выделить:
-
аммиакаты (NH3) [Cu(NH3)4]SO4
-
аквакомплексы (H2O) [Ca(H2O)2]2+
-
карбонилы (CO) [Co(CO)4]
КС, в которых лигандами являются ионы: кислотные остатки, ОН-группы;
цианокомплексы; гидроксокомплексы; хлоркомплексы и т.д.
-
Циклические КС, образуемые би- и полидентатными лигандами;
хелатные комплексы; биологически активные вещества (ферменты, хлорофилл, гемоглобин и т.д.)
Номенклатура КС.
КС любого типа всегда начинают называть с аниона.
Анионные.
K3[Fe(CN)6]3- - гексацианоферрат (III)калия.
-
греч. или лат. числительным указывают координационное число;
-
дают название лиганда с добавлением буквы «О»;
-
указывают латинское название комплексообразователя с добавлением суффикса
-ат- с указанием в скобках заряда иона;
-
дают название ионов внейшней координационной сферы в Р.п.
Катионные.
[Cu(NH3)4](NO3)2 - нитрат тетраамминмеди(II)
-
называют ионы внешней координационной сферы без указания их числа;
-
греч. или лат. числительным указывают название лиганда;
-
указывают русское название комплексообразователя в Р.п. с указанием его заряда;
