
- •М о д у л ь 1. Основні поняття і закони хімії т е м а 1 (вступна). Основні поняття і закони хімії.
- •1.4. Список рекомендованої літератури
- •2.1. Рекомендації до вивчення теоретичного матеріалу
- •2.4. Лабораторна робота
- •2.5. Список рекомендованої літератури
- •3.1.Рекомендації до вивчення теоретичного матеріалу
- •3.2. Приклади розвязування типових задач
- •3.3. Задачі для самостійного рішення: 182, 183, 190, 208
- •3.4. Лабораторна робота
- •3.5. Список рекомендованої літератури
- •4.1. Рекомендації до вивчення теоретичного матеріалу
- •4.2. Приклади розвязування типових задач.
- •4.3. Задачі для самостійного рішення: 720, 724, 736
- •4.4. Лабораторна робота
- •Дослід 3. Утворення сольватокомплексів
- •Дослід 6. Стійкість комплексів
- •4.5. Список рекомендованої літератури
- •М о д у л ь 2. Основні закономірності протікання хімічних реакцій т е м а 5. Енергетика хімічних процесів
- •5.1. Рекомендації до вивчення теоретичного матеріалу
- •5.2. Приклади розвязування типових задач
- •Розв’язок: Температуру початку реакції розрахуємо за формулою:
- •5.3. Задачі для самостійного рішення: № 283, 285, 303, 311
- •5.4. Лабораторна робота
- •5.5. Список рекомендованої літератури
- •Тема 6. Швидкість протікання хімічних реакцій та хімічна рівновага
- •6.2.Приклади розвязування типових задач
- •6.3. Задачі для самостійного рішення: 330, 332, 334, 352
- •6.4. Лабораторна робота
- •Загальні вказівки
- •М о д у л ь 3. Розчини т е м а 7. Розчинність. Способи вираження концентрації
- •8.1. Рекомендації до вивчення теоретичного матеріалу
- •8.3. Задачі для самостійного розвязування: 1030, 1031, 1035, 1037
- •8.4. Лабораторна робота
- •8.5. Список рекомендованої літератури
- •Т е м а 9. Властивості розчинів. Рівноваги у розчинах електролітів
- •9.1. Рекомендації до вивчення теоретичного матеріалу
- •9.2. Приклади розвязування типових задач
- •9.3. Задачі для самостійного рішення: № 516, 544, 586
- •9.4. Лабораторна робота
- •9.5. Список рекомендованої літератури
- •Тема 10. Окисно-відновні реакції
- •10.1. Рекомендації до вивчення теоретичного матеріалу
- •10.2. Приклади рішення типових задач
- •10.3. Задачі для самостійного рішення: 624, 625, 626, 640
- •10.4. Лабораторна робота
- •10.5. Список рекомендованої літератури
- •М о д у л ь 4. Електрохімічні процеси
- •Т е м а 11. Гальванічні елементи
- •11.1. Рекомендації до вивчення теоретичного матеріалу
- •11.2. Приклади розвязування типових задач
- •1.3. Задачі для самостійного рішення: 658, 660, 661
- •11.4. Лабораторна робота
- •11.5. Список рекомендованої дітератури
- •12.1. Рекомендації до вивчення теоретичного матеріалу
- •12.2. Приклади розв’язку типових задач
- •12.4. Лабораторна робота
- •12.5. Список рекомендованої літератури
- •13.1. Рекомендації до вивчення теоретичного матеріалу
- •13.2. Приклади рішення типових задач
- •13.3. Задачі для самостійного рішення 689, 690, 695, 709
- •13.4. Лабораторна робота
- •13.5. Список рекомендованої літератури
- •Тема 14. Властивості неметалів viiа групи (f, Cl, Br, I)
- •14.1. Рекомендації до вивчення теоретичного матеріалу
- •14.2. Приклади розв’язку типових задач
- •14.3. Задачі для самостійного розв’язування: 823, 824, 831.
- •14.4. Лабораторна робота
- •14.5. Список рекомендованої літератури
- •Тема 15. Властивості неметалів viа групи (o, s, Se, Te)
- •15.1 Рекомендації до вивчення теоретичного матеріалу
- •15.2. Приклади розв’язку типових задач
- •15.3. Задачі для самостійного розв’язку
- •15.4. Лабораторна робота
- •15.5. Список рекомендованої літератури
- •Тема 16. Властивості неметалів vа групи (n, p, As, Sb)
- •16.1. Рекомендації до вивчення теоретичного матеріалу
- •16.2. Приклади розв’язування типових задач
- •16.3. Задачі для самостійного розв’язку: 901, 902, 917
- •16.4. Лабораторна робота
- •Дослід 8. Гідроліз фосфатів
- •16.5. Список рекомендованої літератури
- •Тема 17. Властивості неметалів іvа групи (с, Sі)
- •17.1. Рекомендації до вивчення теоретичного матеріалу
- •17.2. Приклади розв’язування типових задач
- •17.3. Задачі для самостійного розв`язку: № 944, 949, 964.
- •17.4. Лабораторна робота
- •17.5. Список рекомендованої літератури
- •М о д у л ь 5. Властивості конструкційних і інструментальних металів і їхніх сполук. Полімерні матеріали
- •18.1. Рекомендації до вивчення теоретичного матеріалу
- •18.2. Приклади розвязування типових задач
- •18.3. Задачі для самостійного рішення: 1009, 1051, 1053
- •18.4. Лабораторна робота
- •Дослід 6. Окисно-відновні властивості сполук титана
- •Дослід 7. Електрохімічне оксидування (анодирування) алюмінію (елементи ндрс)
- •Сполуки водних розчинів для фарбування анодируваного алюмінію
- •18.5. Список рекомендованої літератури
- •Т е м а 19. Властивості заліза, кобальту, нікелю
- •19.1. Рекомендації до вивчення теоретичного матеріалу
- •19.2. Приклади розвязування типових задач
- •19.3. Задачі для самостійного рішення: 1113,1114, 1117, 1118
- •19.4. Лабораторна робота
- •19.5. Список рекомендованої літератури
- •Т е м а 20. Властивості металів підгрупи Cr і Mn і їх сполук
- •20.1. Рекомендації до вивчення теоретичного матеріалу
- •20.2. Приклади розвязування типових задач
- •20.3. Задачі для самостійного рішення: 1084, 1096, 1097
- •20.4. Лабораторна робота
- •20.5. Список рекомендованої літератури
- •21. Властивості металів vb групи (підгрупи ванадію)
- •21.1 Рекомендації до вивчення теоретичного матеріалу
- •21.2. Приклади розв’язування типових задач
- •21.3. Задачи для самостійного розв’язування : №1081, 1082
- •21.4. Лабораторна робота
- •21.5. Список рекомендованої літератури
- •22.1. Рекомендації до вивчення теоретичного матеріалу
- •22.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення: 1071, 1072, 1077
- •2.4. Лабораторна робота
- •Дослід 3. Окисно-відновні властивості сполук станума і плюмбума
- •Дослід 6. Електролітичне лудіння (з елементами ндрс)
- •22.5. Список рекомендованої літератури
- •Т е м а 23. Властивості конструкційних металів ib і iib груп
- •23.1. Рекомендації до вивчення теоретичного матеріалу
- •23.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення 995, 984, 1025
- •23.4. Лабораторна робота
- •23.5. Список рекомендованої літератури
- •24.1. Рекомендації до вивчення теоретичного матеріалу
- •24.2. Лабораторна робота
- •24.3. Список рекомендованої літератури
- •Питання до колоквіуму за темами «Будова атома. Періодичний закон. Властивості елементів. Хімічний зв'язок. Комплексні сполуки. Типи взаємодії молекул»
- •Тиск водяної пари при різних температурах
- •Добуток розчинності (др) важкорозчинних сполук (25оС)
- •Індивідуальні завдання до теми «Основні поняття і закони хімії»
- •Індивідуальні завдання до теми : "Електролітична дисоціація, рН, гідроліз солей"
- •Тема 1. (вступна). Основні поняття і закони хімії
- •Тема 2. Закон еквівалентів…………………………………………………………………....7
- •Тема 3. Будова атома. Періодичний закон. Властивості елементів..................................10
- •Тема 4. Хімічний зв'язок. Комплексні сполуки……………………….....................................15
- •Тема 5. Енергетика хімічних процесів………………………………….................................21
- •Тема 6. Швидкість хімічних реакцій і хімічна рівновага……................................................29
- •Тема 7. Розчинність. Способи вираження концентрації……………..................................33
- •Тема 18. Властивості легких конструкційних металів
8.3. Задачі для самостійного розвязування: 1030, 1031, 1035, 1037
8.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: склянки з пробами води, мірні циліндри, бюретки з розчиномхлоридної (соляної)кислоти, лужної суміші, колби на 100 мл, розчин метилоранжу, фільтрувальний папір, електроплитки; стандартний розчин трилона Б – 0, 05 н., індикатори – мурексид, хромоген чорний Т.
Дослід 1. Визначення карбонатної жорсткoсті
Гідрокарбонати кальцію і магнію у воді піддаються гідролізу і створюють лужне середовище: НСО3-+ Н2ОН2СО3 + ОН-. Тому наявність гідрокарбонатів у воді легко знайти метилоранжем, що у лужному середовищі приймає жовте забарвлення.
Якщо до води, що містить гідрокарбонати, додати соляну кислоту, то іони водню будуть взаємодіяти з іонами НСО3-по рівнянню: НСО3-+Н+=Н2СО3=Н2О+СО2.
Коли настає кінець реакції (момент еквівалентності), жовте забарвлення метилоранжу перетворюється в жовтогаряче.
Хід роботи:
Відмірюють за допомогою мірного циліндру в дві колби по 100 мл води зазначеної проби і додають у кожну по 2-3 краплі метилоранжу. Одна з колб буде служити контрольною.
Визначають рівень соляної кислоти в бюретці.
Додають по краплях соляну кислоту, збовтуючи розчин, поки жовте забарвлення не стане жовтогарячим.
Визначають рівень кислоти після титрування.
Дослід повторюють. У випадку появи рожевого фарбування (надлишок кислоти), дослід необхідно переробити.
Для розрахунків приймають середній
результат. Розрахунок тимчасової
жорсткості проводять по формулі: Ж =
![]() .
.
Дослід 2. Визначення загальної жорсткісті води
Спосіб заснований на осадженні іонів Са2+іMg2+розчином лужної суміші, що складається зNaOH і Na2CO3:
Са(НСО3)2+2NaOH СаСО3+Na2CO3+2H2O
CaSO4+ Na2CO3 CaCO3+Na2SO4.
Лужну суміш беруть у надлишку. Частина суміші, що непрореагувала, визначається титруванням 0,1 н. соляною кислотою (метод зворотного титрування).
Хід роботи:
Відмірюють за допомогою мірного циліндру в термостійку колбу 100 мл досліджуваної води. У ту ж колбу додають 20 мл 0,1 н. розчину лужної суміші (10 мл 0,1 н. NaOH і 10 мл 0,1 н. Na2CO3).
Кип'ятять розчин протягом 3-х хвилин, а потім дають йому охолонути.
Охолоджений розчин фільтрують через складчастий фільтр. (Фільтрат містить непрореаговану частину лужної суміші).
До фільтрату додають 2-3 краплі метилоранжу.
Титрують фільтрат 0,1 н. соляною кислотою до переходу забарвлення в жовтогарячий колір.
Обчислюють загальну жорсткість води за формулою:
Жз=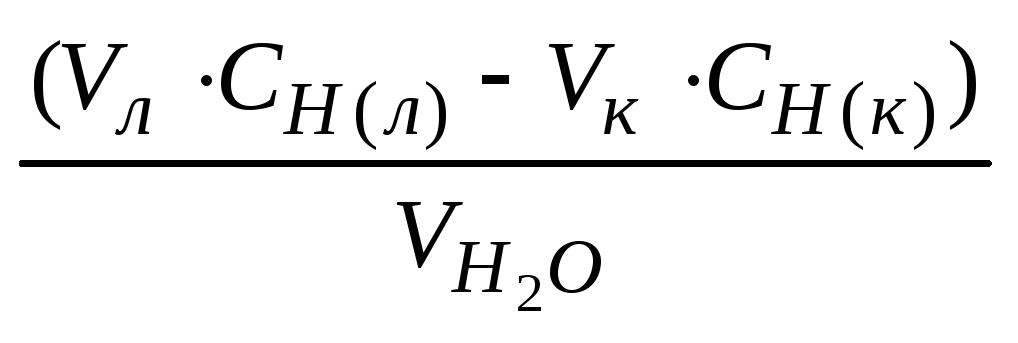 ,
де Жз– загальна жорсткість води,
м екв/л,Vл – обєм
розчину лужної суміші, мл, С(н) л– нормальна концентрація розчину лужної
суміші,Vк –
обєм
розчину кислоти, витраченої на
титрування,V
,
де Жз– загальна жорсткість води,
м екв/л,Vл – обєм
розчину лужної суміші, мл, С(н) л– нормальна концентрація розчину лужної
суміші,Vк –
обєм
розчину кислоти, витраченої на
титрування,V![]() – обєм води, мл.
– обєм води, мл.
Визначають постійну жорсткість води: від загальної жорсткості води віднімають тимчасову.
Дослід 3. Комплексонометричне визначення жорсткості води
У практиці технічного лабораторного аналізу води найчастіше використовують комплексонометричний метод, застосований на титруванні зразка води комплексоном ІІІ (двонатрієва сіль етилендіамінтетраоцтової кислоти, або трилон Б) (ЕДТА, або Na2H2Y).
Комплексон ІІІ утворює з багатьма катіонами, у тому числі, і з катіонами лужноземельних металів (Ca2+, Mg2+, Ba2+), стійкі розчинні у воді внутрішньокомплексні солі (за рахунок заміщення атомів Н у групах СООН і утворення додаткових координаційних зв’язків з обома N-атомами). Алаліз води на вміст іонів Ca2+ і Mg2+ проводять у лужному середовищі, використовуючи різні індикатори: для визначення суми іонів Ca2+ і Mg2+ - хромоген чорний спеціальний ЕТ-00 (зарубіжна назва – еріохром чорний Т); для визначення іонів Ca2+ - мурексид (амонійна сіль пурпурної кислоти). У обох випадках при титруванні в еквівалентній точці винно-червоний колір розчину змінюється на синій.
Хід роботи:
а) Визначення загальної жорсткості води (суми [Ca2+] і [Mg2+]). В колбу для титрування відбирають 100 мл досліджуваної води, додають 5 мл амонійної буферної суміші (рН≈10) і 20-30 мг (на кінчику шпателя) сухої суміші індикатора хромогену чорного з NaCl (1:100) до появи чіткого, але не дуже інтенсивного винно-червоного кольору розчину. Титрують воду 0,05 н. робочим розчином комплексна ІІІ до переходу винно-червоного кольору в синій (в кінці титрування розчин комплексна треба додавати краплинами до змінення червоного відтінку розчина). Дослід повторюють 203 рази. Загальну жорсткість води (в мекв Ca2+і Mg2+ на 1 л) розраховують за формулою:
![]()
де СН – нормальність розчину комплексна ІІІ; V1–об’єм робочого розчину комплексна, витраченого на титрування, мл;V - об’єм води, взятий для аналізу, мл.
б) Визначення вмісту іонів Ca2+ і Mg2+ у воді. Відбирають для аналізу 100 мл води, додають 20 мл 2н. розчину NaOH, декілька кристалів мурексиду до помірного забарвлення розчину і титрують до зміни кольору від червоного до синьо-фіолетового. Вміст іонів Ca2+ розраховують за тією ж формулою, що у досліді 3а. вміст іонів Mg2+ знаходять з формули: ЖЗ=ЖCa2+ + ЖMg2+
У висновках укажіть:яку ступінь жорсткості має досліджена вами проба води?
