
Для неорганических веществ: Для органических веществ:


Пример: для H2(г)- неорганическое вещество
|
Ср=f(T) |
Т |
|||
|
a |
b*103 |
c’*10-5 |
289-3000 |
|
|
27,28 |
3,26 |
0,50 |
||
Ср(Н2(г))=27,28+3,26*10-3Т+ .
.
а) Приближенное интегрирование:
для изобарного процесса




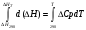
∆HT - ∆H298=∆Cp*(T-298)

для изохорного процесса:

Таким образом, для определения теплового эффекта ∆H или внутренней энергии ∆U при любой температуре Т необходимо знать теплоту процесса в стандартных условиях ∆H0 (∆U0) и изменение теплоемкостей ∆Ср, ∆Cv.
Пример. Рассчитаем тепловой эффект ∆H процесса получения бензола из ацетилена:
3С2Н2(г)→С6Н6(г) при 750С(348К).
Решение:
1.Находим по таблицам среднее мольное изобарные теплоемкости бензола и ацетилена:
СрС6Н6(г) = 81,67Дж/(моль*К);
СрС2Н2(г) = 43,93Дж/(моль*К).
2.Находим изменение теплоемкости процесса:
∆Ср=∑(nСр)кон — ∑(nСр)нач = СрС6Н6(г) — 3* СрС2Н2(г)= 81,67 — 3*43,93 = - 50,12 Дж/(моль*К).
3. По табличным данным находим тепловой эффект в стандартных условиях:
∆H0 = ∆H0обр С6Н6(г) — ∆H0обр С2Н2(г) = 82,93 – 3*226,73 = - 597,26 кДж/моль
-
Находим тепловой эффект при заданной температуре:
∆H = ∆H0+∆Ср(Т-Т0)= - 597,26*103 +(-50,12)*(348- 298) = -599766 Дж/моль
б) Точное интегрирование:
Рассмотрим второй, более сложный случай, когда изменение теплоемкости зависит от температуры, т.е. Ср=f(T), Cv=f(T).
Обратимся к уравнению реакции в общем виде
dD + rR = qQ+ pP
|
|
a |
b*103 |
c’*10-5 |
C*106 |
|
D |
+ |
+ |
- |
+ |
|
R |
+ |
+ |
+ |
- |
|
Q |
+ |
+ |
+ |
- |
|
P |
+ |
+ |
+ |
- |
∆a=q*a(Q) + p*a(P) — [d*a(D) + r*a(R)];
∆b=q*b(Q) + p*b(P) — [d*b(D) + r*b(R)];
∆c’= q*c’(Q) + p*c’(P) — [r*c’(R)];
∆c= -dc(D)



Те же операции проведем для изохорного процесса:

При помощи этих уравнений можно рассчитать тепловой эффект реакции при любой температуре, зная тепловой эффект реакции в стандартных условиях, который определяют по теплотам образования или сгорания.
Теплота растворения
Изменение энтальпии при переходе твердого, жидкого или газообразного вещества в раствор называют тепловой или энтальпией растворения.
Теплота растворения в общем случае включает в себя теплоты разрушения кристаллической решетки (для твердых веществ), ионизация и сольватация.
Для разрыва связи между ионами кристаллической соли необходима энергия, т.е. при этом теплота поглощается. В то же время в водном растворе происходит гидратация ионов, т.е. образуется связь между ионами и молекулами Н2О. Знак теплоты растворения определяется тем процессом, который энергетически сильнее выражен.
LiBr: ∆Hраст = - 49,02 кДж/моль – теплота выделяется
КСl: ∆Hраст = 7,23 кДж/моль – теплота поглощается
Различают: интегральную теплоту растворения — это та теплота, которая выделяется или поглощается при растворении 1 моля данного вещества с образованием раствора данной концентрации. Интегральная теплота растворения изменяется в зависимости от количества растворяемого вещества.
Различают: дифференциальную теплоту растворения — эта та теплота, которая сопровождает растворение 1 моля данного вещества в бесконечно большом объеме раствора данного вещества. Интегральные теплоты широко используются в расчетах теплот образования и теплот других реакций по закону Гесса. Дифференциальные теплоты растворения характеризуют термодинамические свойства растворов и процесс их образования.
