
Жимулёв Курс лекций
.pdf



|
|
|
|
|
|
|
|
|
|
Глава 7. Структура гена |
|||||
Энхансер |
|
|
|
|
|
индукции у них устроены регуляторные |
|||||||||
|
|
|
|
|
районы (Рис. 7.44.). |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
+ + |
|
CTD |
|
В неиндуцированной тепловым |
||||||||
|
AR |
|
|
|
|
||||||||||
|
|
|
|
|
|
шоком клетке (Рис. 7.44а.) находятся |
|||||||||
|
|
|
|
Srb |
Swi/Snf |
||||||||||
|
|
|
|
Gal11 |
|
белковые факторы HSF, они неактивны и |
|||||||||
|
|
|
Taf |
F |
Sin4 |
H |
не связываются с промоторными HSE- |
||||||||
|
|
|
|
|
Rgr1 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
A |
TBP |
|
Pol II |
E |
элементами. РНК-полимераза II занимает |
||||||||
|
|
B |
|
||||||||||||
|
|
|
|
участок гена в районе точки инициации |
|||||||||||
|
|
|
TATA |
Инициатор |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
Ðèñ. |
7.40. |
Белки |
â |
ÐÍÊ |
|
транскипции. |
|
Ïîä |
|
воздействием |
|||||
типичном |
теплового |
øîêà |
|
белок |
HSF |
||||||||||
промоторе эукариот (Из: Struhl, 1996) |
|
||||||||||||||
модифицируется |
è |
связывается |
ñ |
||||||||||||
|
|
|
|
|
|
|
|||||||||
белки, |
необходимые для контроля |
промотором гена hsp. Это активирует |
|||||||||||||
РНК-полимеразу II, либо воздействуя на |
|||||||||||||||
процесса |
образования |
белкового |
ТАТА-домен, |
|
|
ëèáî |
|
освобождая |
|||||||
комплекса на промоторе. |
|
|
гипотетический белок “Х”, блокирующий |
||||||||||||
Íèæå |
|
приведены |
примеры |
РНК-полимеразу II (см. Рис. 7.44.). |
|
|
|||||||||
организации регуляторных участков, |
Некоторые |
|
èç |
|
генов |
hsp |
|||||||||
обнаруженных у генов эукариот. |
|
индуцируются |
|
также |
гормонами. |
||||||||||
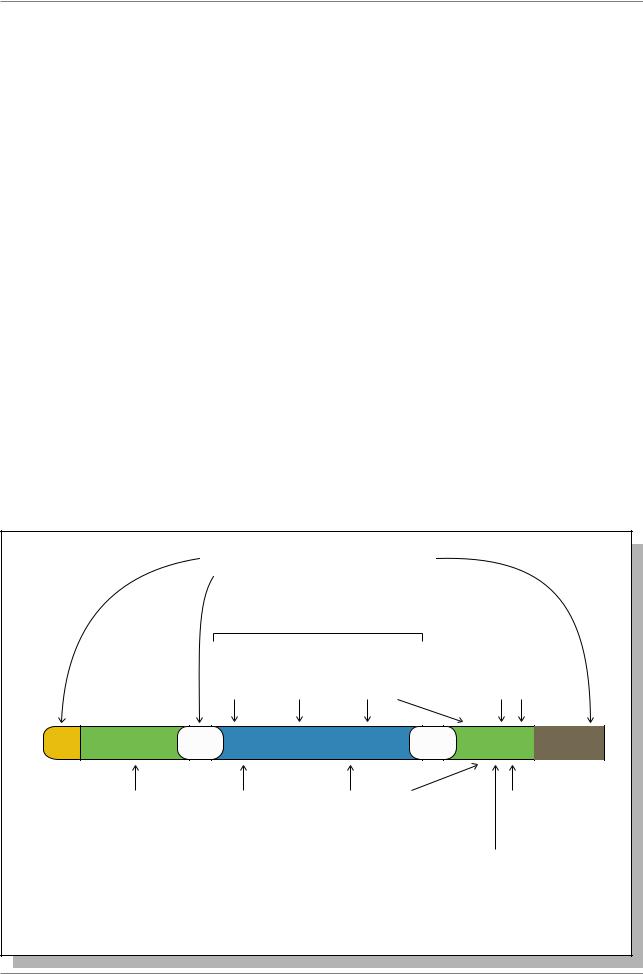
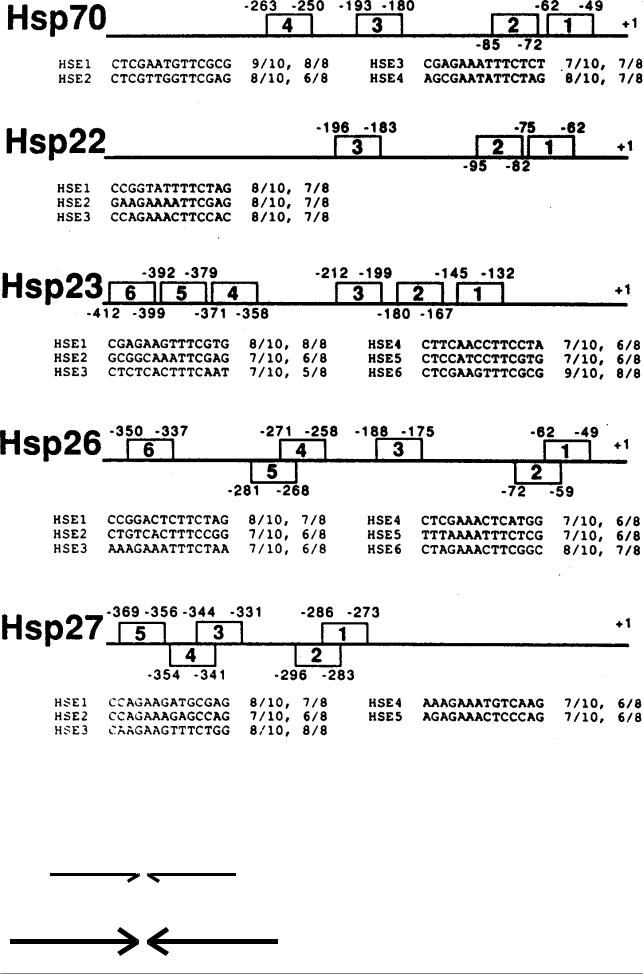
Гены, отвечающие на тепловой шок |
Соответственно, промоторы этих генов |
||||||||||||||
(см. раздел 12.), имеют в составе |
организованы сложнее (Рис. 7.45.). В них |
||||||||||||||
регуляторной зоны от трех до шести |
перемежаются |
|
контролирующие |
||||||||||||
“элементов теплового шока” (HSE) (Рис. |
элементы обоих типов. |
|
|
|
|
||||||||||
7.42.), которые представлены 14- |
7.8.2. Метод репортерных |
|
|
||||||||||||
членными |
|
последовательностями |
|
|
|||||||||||
нуклеотидов (Рис. 7.43.). |
|
|
генов для изучения |
|
|
|
|
||||||||
Известно, что гены теплового шока |
промоторных участков генов |
|
|||||||||||||
очень |
быстро |
реагируют |
íà |
Одним из подходов к изучению |
|||||||||||
индуцирующее воздействие (см. раздел |
организации регуляторной части гена |
||||||||||||||
12.). В соответствии с таким типом |
является методика репортерных генов, |
||||||||||||||
|
|
|
|
|
|
общие |
|
|
|
|
|
|
|
||
|
|
|
|
|
транскрипционные |
|
|
|
|
|
|
|
|||
регуляторные белки |
|
факторы |
|
|
|
регуляторные |
|
||||||||
|
|
РНК-полимераза II |
белки |
|
|
||||||||||
|
|
спейсер |
|
|
ÒÀÒÀ |
промотор |
|
|
ãåí X |
|
|
|
|||
|
регуляторные |
|
|
|
|
|
|
|
|
|
|
||||
последовательности |
|
|
|
РНК-транскрипт |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||||||
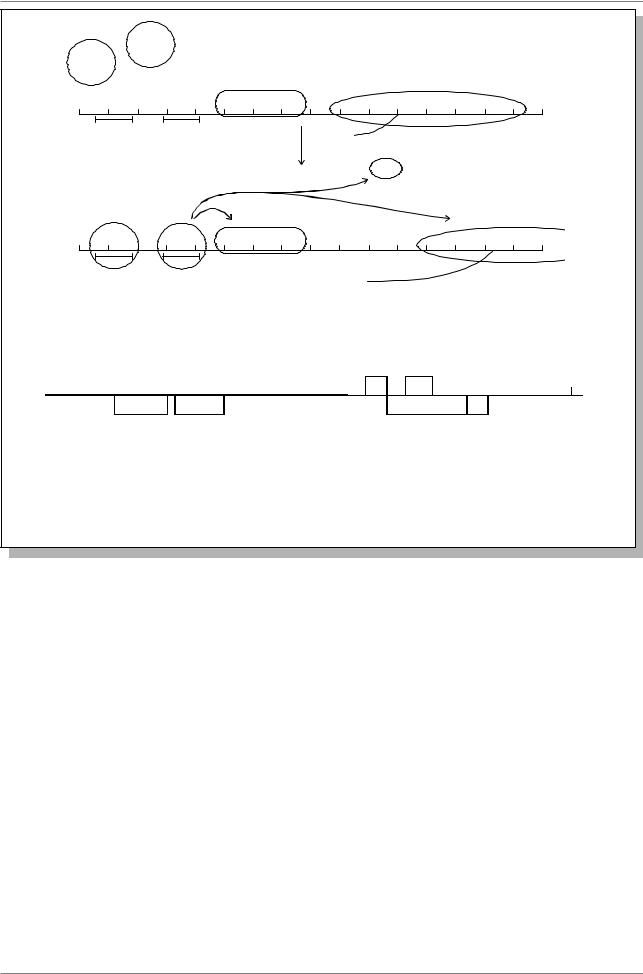
Рис. 41. Схема организации контролирующего района типичного гена |
|
||||||||||||||
эукариот, состоящего из регуляторных последовательностей и промотора |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
7-49 |
||
Глава 7. Структура гена
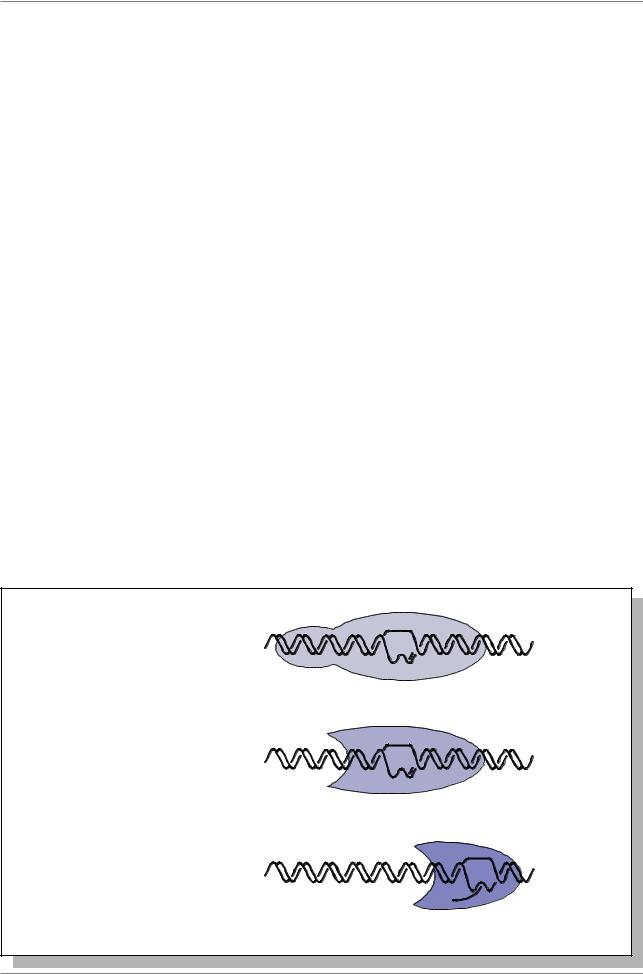
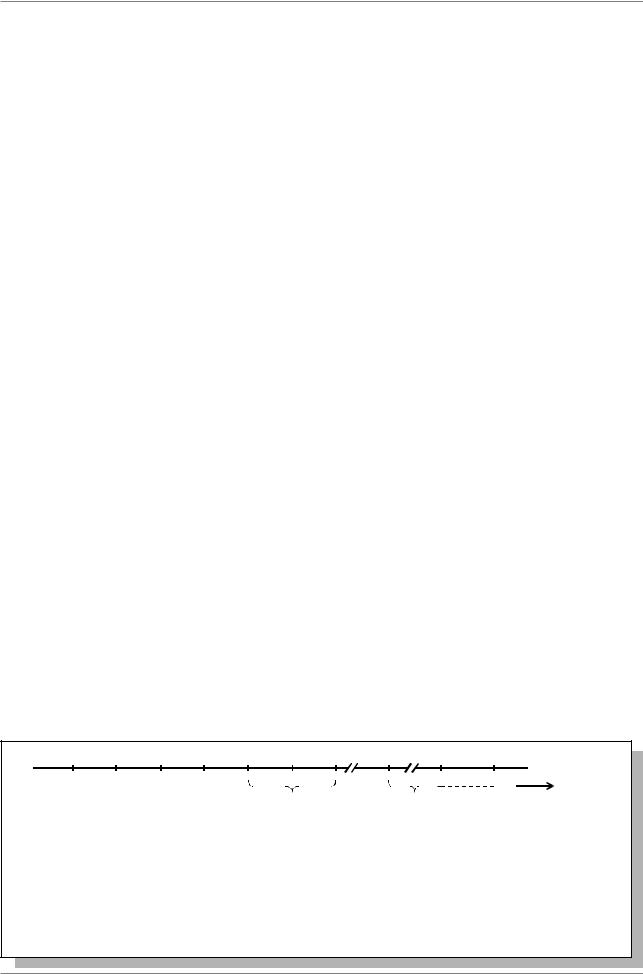
Рис. 7.42. Локализация HSE элементов в регуляторных областях генов теплового шока hsp70, hsp22, hsp23, hsp26 и hsp27 у дрозофилы (Из: Simon, Lis, 1987 в кн. Жимулев, 1994, стр. 343). Номера элементы обозначены цифрами в прямоугольниках. Внизу приведены последовательности нуклеотидов в каждом HSE 
C--GAA--TTC--G

 TFIID
TFIID TFIIB
TFIIB