
- •1.1.1 Рабочее тело
- •1.1.2 Состояние рабочего тела. Параметры состояния.
- •1.2. Газовые смеси Характеризуются законом Дальтона, который гласит:
- •1.3. Понятие о равновесном и обратимом процессах.
- •1.4. Теплоемкость газов.
- •1.5. Первый закон термодинамики.
- •1.5.1. Уравнение первого закона термодинамики.
- •1.6. Функции состояния и функции процесса.
- •1.7. Энтропия как параметр состояния идеального газа.
- •1.8. Работа газа при неравновесном процессе.
- •1.8. Исследование газовых процессов.
- •Политропные процессы
- •I Закон термодинамики для потока газа .
- •II-й закон термодинамики.
- •Круговые процессы (циклы).
- •Цикл Карно.
- •Т1 и т2 - температуры горячего и холодного источников тепла
- •Эквивалентный цикл Карно
- •Пример:
Термодинамика.
Дополнительная
5. Уонг Х. Основные формулы и данные по теплообмену для инженеров: Пер. с англ. / Справочник. – М.: Атомиздат, 1979. – 216 с.
Введение
Термодинамика (от гр. Therme – тепло и dinamikos - силовой) – наука о соотношении между теплом, работой и физико-химическими свойствами систем.
Система – любая совокупность материальных тел внутри заданных границ. В общем случае система взаимодействует с окружающей средой.
Термодинамика как самостоятельная наука выделилась из физики с середине 19 века.
Раздел термодинамики, главной проблемой которого является превращение тепловой энергии в механическую, называется – Технической термодинамикой, а машины используемые для этой цели – тепловыми двигателями.
Типы тепловых двигателей:
Паровые турбины (ТЭЦ, морские суда)
Паровые машины (Вытеснены другими)
Двигатели внутреннего сгорания /д. в. с./ (Транспорт)
Газовые турбины (Небольшая мощность)
Реактивные двигатели (Для больших скоростей)
Для всех тепловых двигателей необходимо затрачивать тепло.
80 % получаемой энергии человечество получает за счет сжигания топлива.
На очереди стоит применение регулируемой термоядерной реакции.
Преобразование тепловой энергии в электрическую непосредственно:
ТЭГ – термоэлектро генератор
ТИГ – термоионный генератор
МГДГ – магнитогидравлический генератор
ХЭГ – химикоэлектро генератор
Другой проблемой технической термодинамики является проблема получения холода за счет затраты работы. Такие машины называются холодильниками.
Методы исследования тепловых двигателей аналогичны методам исследования холодильных машин.
Термодинамика основывается на 2х законах, которые установлены опытным путем.
Термодинамика не объясняет причины того или иного протекания процессов.
В настоящее время термодинамика быстро развивается, что обусловлено применением качественно новых рабочих тел (плазма); новых методов преобразования энергии.
1.1.1 Рабочее тело
это вспомогательное вещество, с помощью которого происходит преобразование тепловой энергии в механическую. Окружающая среда – то что находится вокруг рабочего тела.
В качестве рабочего тела могут применяться любые вещества, в любом агрегатном состоянии.
Например: стальной стержень при нагревании-охлаждении будет расширяться или сжиматься .
Чаще в качестве рабочего тела применяют газы. Газы обладают большим коэффициентом теплового расширения, легко деформируются и имеют малый вес.
Рабочие тела – являются макротелами, энергия их движения – механическая.
Тепловая энергия – хаотическое движение молекул (микро тел).
1.1.2 Состояние рабочего тела. Параметры состояния.
Состояние рабочего тела характеризуется параметрами состояния
Удельный объем; плотность.



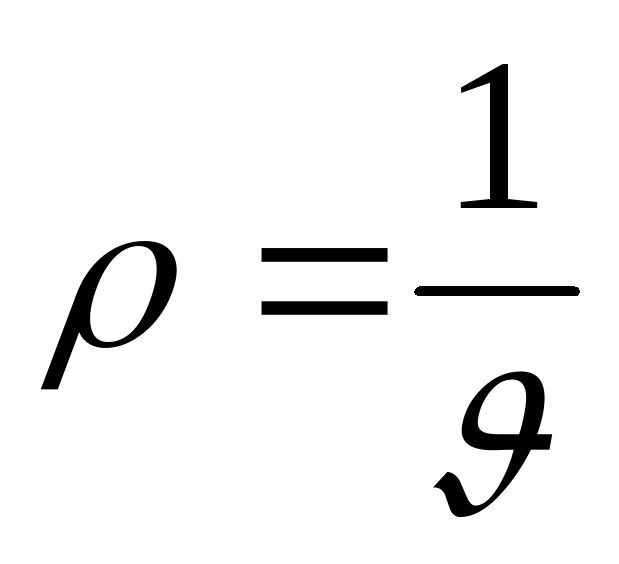
Удельный вес.
![]()
Давление – сила, приходящаяся на единицу площади ограничивающей оболочки.
![]() -
абсолютное давление.
-
абсолютное давление.
Приборы чаще показывают разность абсолютного и барометрического давления.
В случае разрежения
применяют вакуумметры
![]()
Параметром состояния является только абсолютное давление.
![]() - принимают в
практике.
- принимают в
практике.
Пересчёт давления в различных единицах измерения:
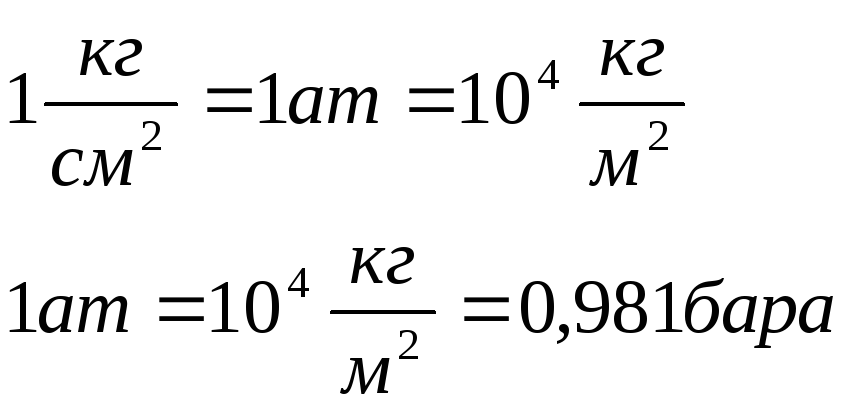
![]()
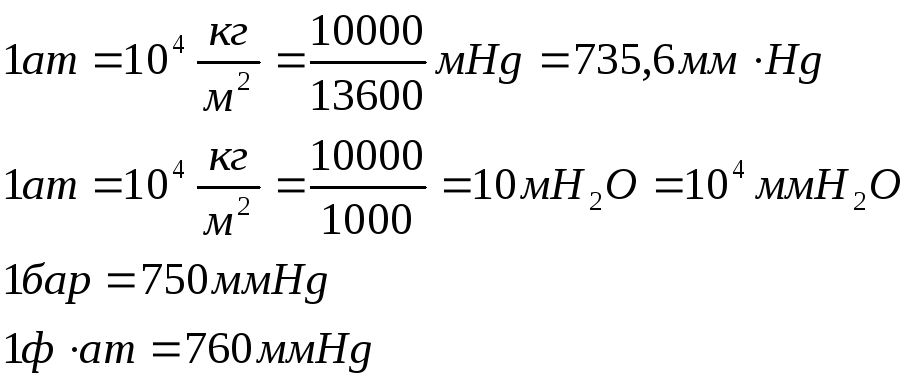
Температура
– определяет степень нагретости тела косвенным путем – характеризует среднюю кинетическую энергию движения молекул.
Связь градусов Кельвина и Цельсия:
![]()
Любое свойство рабочего тела характеризуются двумя заданными параметрами, третий параметр определяется из уравнения состояния идеального газа.
1.1.3. Уравнение состояния идеального газа.
Идеальным называется газ, в котором объем молекул пренебрежимо мал, в нём нет сил притяжения и отталкивания между молекулами.
Идеальный газ характеризуется законами Гей-Люссака и Бойля Мариотта.
Клайперон вывел уравнение состояния:
![]() - для 1 кг газа
- для 1 кг газа
R- газовая постоянная
![]()
Это работа, совершаемая одним килограммом газа при его нагреве на один градус при постоянном давлении.
Рассмотрим термодинамические параметры воздуха при нормальных физических условиях:
![]()
![]()
![]()
![]()
![]() -
универсальная газовая постоянная
-
универсальная газовая постоянная
Для кислорода
(О2)
![]()
а) Для массы М
газа
![]()
б) Для 1 моля газа
![]()
1.2. Газовые смеси Характеризуются законом Дальтона, который гласит:
Каждый газ производит такое парциальное давление, какое имел бы этот газ, заполняя один весь предоставленный смеси объем.
![]() ,
,
где Pi – парциальное давление.
Для газовой смеси применимо уравнение Клайперона:
![]()
а) Смесь задана массовыми долями, каждый газ имеет массу Мi; MII; MIII и т.д.
![]()
![]() -
массовая доля;i
– компонент смеси.
-
массовая доля;i
– компонент смеси.
Газовая постоянная
смеси
![]() ,
где
,
где
![]() -
молекулярный вес смеси.
-
молекулярный вес смеси.
![]() ,
,
nсм – число молей смеси.
![]()

![]()
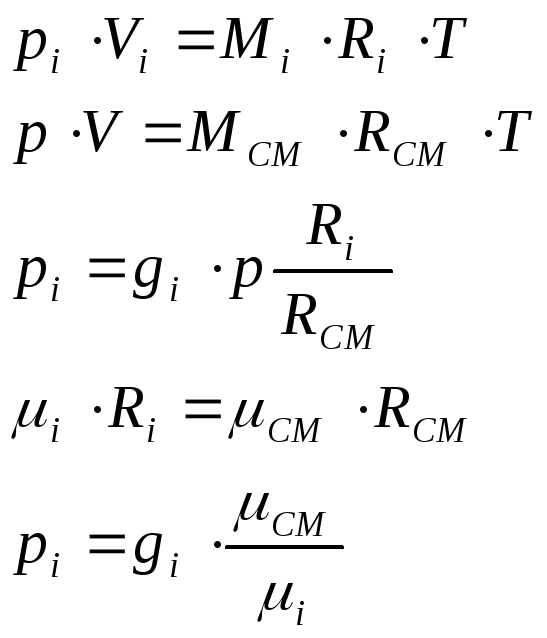
б) Смесь задана объемными долями.
Используется понятие о приведенном или парциальном объеме.
Парциальным объемом данного компонента называется объем, который занял бы этот компонент если бы он имел параметры смеси.
![]() -
закон Амага
-
закон Амага
![]() - объемная доля i
– компонента.
- объемная доля i
– компонента.
![]()
![]()
![]()
![]()
![]()
![]()
![]() и т.д.
и т.д.
![]()
![]()
в) Смесь задана мольными долями.
ni – число молей i компонента в смеси.
![]()
![]() -
мольная доля i
компонента.
-
мольная доля i
компонента.
Докажем, что мольная доля численно равна объемной доле ri
По закону Авогадро
при одинаковых давлениях и температурах
![]() - одинаковы, поэтому объем всей смеси:
- одинаковы, поэтому объем всей смеси:
![]()
![]()
![]()
Этот случай по
аналогии:
![]() ;
;![]()
Сравним формулы парциальных давлений:
![]() ,
,
отсюда
![]()
Пример 1.
Для сухого воздуха, который состоит по объему из 21% О2; 79% N2 определить газовую постоянную R; и парциальные давления Pi;
PСМ=760 мм рт. ст.
Решение:
![]()
![]() мм рт. ст.
мм рт. ст.
![]() мм рт. ст.
мм рт. ст.
Пример 2.
Определить массовый мольный состав воздуха.
![]()
![]()
![]()
![]()
