
- •1.1.1 Рабочее тело
- •1.1.2 Состояние рабочего тела. Параметры состояния.
- •1.2. Газовые смеси Характеризуются законом Дальтона, который гласит:
- •1.3. Понятие о равновесном и обратимом процессах.
- •1.4. Теплоемкость газов.
- •1.5. Первый закон термодинамики.
- •1.5.1. Уравнение первого закона термодинамики.
- •1.6. Функции состояния и функции процесса.
- •1.7. Энтропия как параметр состояния идеального газа.
- •1.8. Работа газа при неравновесном процессе.
- •1.8. Исследование газовых процессов.
- •Политропные процессы
- •I Закон термодинамики для потока газа .
- •II-й закон термодинамики.
- •Круговые процессы (циклы).
- •Цикл Карно.
- •Т1 и т2 - температуры горячего и холодного источников тепла
- •Эквивалентный цикл Карно
- •Пример:
Т1 и т2 - температуры горячего и холодного источников тепла
1-2 – изотерма с подводом тепла
2-3 – адиабата расширения
3-4 – изотерма сжатия с отводом тепла
4-1 – адиабата сжатия
Подведённое
тепло:
![]()
Отведённое
тепло:
![]()
Отношение работы, произведённой двигателем за цикл, к количеству теплоты, подведённой за этот цикл от горячего источника, называется термическим кпд цикла Карно:
![]()
- зависит только от температур теплоотдачика и термоприёмника Т1 и Т2
Термический КПД обратимого цикла Карно зависит только от абсолютных температур теплоотдатчика и теплоприемника. Он будет тем больше, чем выше температура теплоотдатчика и чем ниже температура теплоприемника. Термический КПД цикла Карно всегда меньше единицы, так как для получения КПД, равного единице, необходимо, чтобы Т2=0 или подведённое тепло было ба равно бесконечности, что неосуществимо. Термический КПД цикла Карно не зависит от природы рабочего тела и равен нулю, если тела находятся в тепловом равновесии, то невозможно теплоту превратить в работу.
Термический КПД цикла Карно имеет наибольшее значение по сравнению с КПД любого цикла, осуществляемого в одном и том же интервале температур. Поэтому сравнение термических КПД любого цикла и цикла Карно позволяет делать заключение о степени совершенства использования теплоты в машине, работающей по данному циклу.
В реальных двигателях цикл Карно не осуществляется вследствие практических трудностей. Однако теоретическое и практическое значение цикла Карно весьма велико. Он служит эталоном при оценке совершенства любых циклов тепловых двигателей.
всегда ht < 1
Эквивалентный цикл Карно
Рассмотри произвольный цикл и цикл Карно с эквивалентной совершённой работой. Площади фигур в координатах T-s равны.


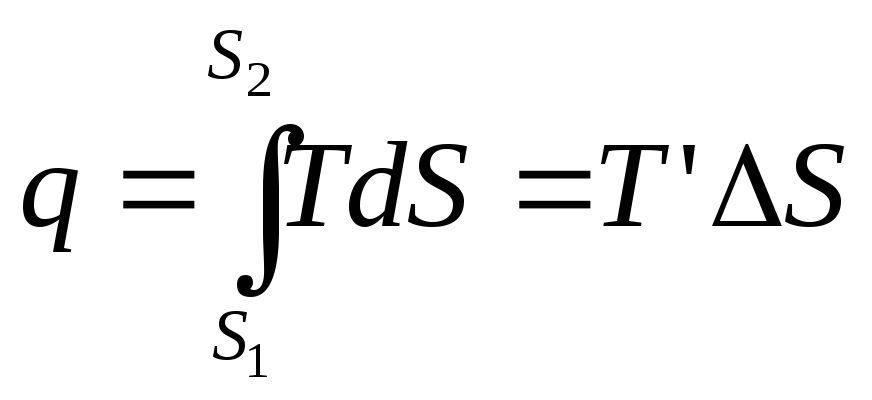
T’ – термодинамическая температура
Т2’ – средняя Т° отводимого тепла
В результате получим вместо произвольного цикла эквивалентный цикл Карно 1234.
![]()
![]()

Термический КПД произвольного цикла равен термическому КПД цикла Карно, взятому при средних температурах подвода и отвода тепла.
В идеале необходимо стремиться к увеличению Т1’ и уменьшению T2’.
Докажем, что в заданном интервале температур термический КПД цикла Карно – максимальный.
![]() >
>![]() ,
т.к.Т1’
<
T1
T2’
>
T2
,
т.к.Т1’
<
T1
T2’
>
T2
htK > ht
Цикл Карно – есть идеальный цикл по величине htK по его значению судят о предельно возможном КПД реального двигателя.
Пример: Определить максимально возможный КПД двигателя, в котором Т1=1800°С Т2=27°С
![]()
Обобщенный цикл Карно. Регенерация тепла в цикле.
Обобщенный цикл Карно – цикл, состоящий из из 2-х изотерм и 2-х эквидистантных политроп.

аб
– расширение
![]()
Подводимое тепло q1= abb’a’
сd
– сжатие
![]()
Отводимое тепло q2= cdd’c’
qbc – отводится тепло …
qdc – подводится тепло из …
Т.к. bc и dc – эквидистантны, то:
![]()
За цикл от окружающей среды поступает только:
![]()
Отводится в среду за цикл:
![]()
![]()
Термический КПД этого цикла равен термическому КПД цикла Карно.
Регенерацией тепла в циклах называется использование тепла, взятого на одном участке цикла, для совершения процесса на другом участке цикла с одинаковыми температурами.
Обратный цикл и его характеристика.
Обратным называют цикл, который в координатных осях совершается против часовой стрелки.


![]()
В результате такого цикла передается тепло от среды с меньшей температурой к среде с большей температурой.
Характеристикой этого цикла является холодильный коэффициент e.
![]()
Математическое выражение II-го закона термодинамики. Характеристика обращенных процессов.
Для цикла Карно: Для любого цикла:
![]()
![]()
Следовательно, для цикла Карно:
![]() q2
– всегда с минусом.
q2
– всегда с минусом.
Поэтому:
![]() (1)
(1)
![]() - приведенная
теплота, следовательно, для цикла Карно
сумма приведенных теплот =Q.
- приведенная
теплота, следовательно, для цикла Карно
сумма приведенных теплот =Q.
Теперь установим аналогичную характеристику для цикла произвольной формы. Пусть в диаграмме T-S имеем произвольный прямой обратимый цикл для 1 …

Проведем ряд адиабат, в результате цикл разбили на ряд элементарных циклов, в каждом из которых 2 адиабаты и 2 приведенных участка. Вследствие малости криволинейные участки можно заменить изотермами, получим цикл Карно.
Совокупность элементарных циклов заменит исходный цикл, т.к. адиабаты как бы уничтожат друг друга.
Тепло
![]() подводится
подводится![]() и
и![]() отводится при
отводится при![]() .
.
На основании уравнения (1)
![]()
для 2 – го
![]() и т.д.
и т.д.
Пройдя весь контур:
![]() (2)
(2)
(2) является математической характеристикой обратимых циклов.
Следствие из уравнения (2)
1.Энтропия есть
параметр состояния для любого веществ,
т.к. если
![]() ,
то подынтегральная функция есть полный
дифференциал, т.е. дифференциальный –
параметр состояния.
,
то подынтегральная функция есть полный
дифференциал, т.е. дифференциальный –
параметр состояния.
При выводе
уравнения (2) мы брали любое рабочее
тело, поэтому и параметры S
– свойство любого рабочего тела.
![]()
![]() (3)
(3)
(3) – только для обратимых циклов.
Отчет энтропии ведут от нормального состояния газа. Поэтому:
![]()
PH=760 мм Hg
TH=273 K
![]()
2. Энтропия адиабатно изолированной системы, в которой совершается обратимые циклы, остается постоянной:
![]()
Это следствие вытекает из определение обратимого процесса и из равенства:
![]()
Характеристика необратимых процессов.
T



S
В диаграмме T –S дан необратимый цикл совершаемый любым рабочим телом, произвольно.
Необратимость
отразим конечной разностью
![]() рабочего тела и источников.
рабочего тела и источников.
В результате проведения адиабат получим элементарные циклы.
![]() подвода
можно считать изетормой.
подвода
можно считать изетормой.
В результате получим необратимый цикл Карно:
![]()
dq1 – подводимое; dq2 – отводимое; кн – цикл Карно необратимый.
Если бы цикл был обратимый, то он совершался бы в интервале температур от T1 до T2:
![]() но
но
![]() ;
;
![]()
![]()
тогда
![]() и
и![]() т.к.q2
всегда отрицательное.
т.к.q2
всегда отрицательное.
![]() .
.
Пройдя по всему контуру исходного цикла можно написать:
![]() (4) – для
необратимых циклов;
(4) – для
необратимых циклов;
![]() (5) – объединяем
(2) и (4)
(5) – объединяем
(2) и (4)
Изменение энтропии при необратимом процессе.

1а2 – необратимый процесс
2в1 – обратимый процесс
В условии цикл необратимый, поэтому на ос
 нование
(4):
нование
(4):
![]() интервале
температур
интервале
температур
![]()
для 2в1
![]() и
и![]() ,
и тогда
,
и тогда![]() (6)
(6)
? интеграл ? изменения энтропии, поэтому расчет нельзя вести количественно по конечным разностям.
Применительно к адиабатному процессу:
![]()
![]() .
.

1 – 2 – обратимый адиабатный процесс;
1` - 2` - необратимый адиабатный процесс.
Необратимый процесс всегда идет с увеличенем энтропии.

