
- •Государственное образовательное учреждение высшего профессионального образования
- •Введение
- •Краткие теоретические сведения Весовой (гравиметрический) анализ
- •Метод отгонки
- •Метод выделения
- •Метод осаждения
- •Расчёты в гравиметрическом анализе Расчёт массы навески исследуемого вещества
- •Расчет объёма раствора осадителя
- •Расчеты результатов весового анализа при использовании метода осаждения
- •Объёмный (титриметрический) анализ
- •Понятия, применяемые для обработки результатов титрования
- •Расчеты в титриметрическом анализе
- •Кривые титрования
- •Кривая титрования сильной кислоты щёлочью
- •Кривая титрования сильного основания кислотой
- •Кривая титрования слабой одноосновной кислоты щёлочью
- •Кривая титрования слабого однокислотного основания сильной кислотой
- •Кривая титрования слабой многоосновной кислоты
- •Кривая титрования смеси сильной и слабой кислот
- •Кривая титрования раствора соли слабого электролита
- •Окислительно-восстановительное титрование
- •Комплексонометрия
- •Некоторые правила записи результатов анализа
- •Содержание отчёта
- •Лабораторный практикум Лабораторная работа № 1 «Определение содержания железа весовым методом»
- •Лабораторная работа № 2. «Определение содержания соды в присутствии щёлочи»
- •Лабораторная работа № 4. «Йодометрическое определение содержания меди»
- •Лабораторная работа № 5. «Определение содержания кальция и магния в совместном присутствии»
- •Лабораторная работа № 6. «Определение содержания цветных металлов трилонометрическим методом»
- •Задачи для решения
- •Литература
- •Содержание
Комплексонометрия
Аналитическая реакция – связывание определяемого элемента в растворимый комплекс. В качестве титрантов используют органические комплексоны с несколькими функциональными группами в молекуле, которые образуют с катионами металлов пяти- или шестичленные гетероциклы, называемые хелатами. Наиболее распространённый комплексон – дигидроэтилендиаминтетраацетат натрия, имеющий техническое название трилон Б.Формула трилона Б следующая:
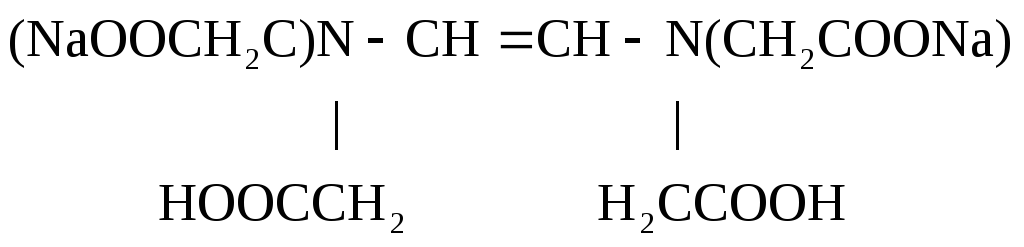
Образующийся в результате диссоциации в растворе анион дигидроэтилендиаминтетраацетата H2Tr2реагирует с катионами металлов по уравнению:
![]() .
.
Как следует из уравнения реакции, она протекает не в эквивалентных, а в молярных соотношениях: 1 моль определяемого элемента на один моль трилона Б. Поэтому для расчёта результатов используют не нормальные, а молярные концентрации.
Индикаторы трилонометрического титрования – это слабые окрашенные органические кислоты, образующие с катионами металлов комплексы, менее устойчивые, чем комплексы с трилоном Б. При добавлении индикатора раствор окрашивается за счёт образования металл-индикаторного комплекса:
![]() .
.
С индикатором связана малая часть катионов металла. Остальные катионы определяемого элемента в ходе титрования постепенно связываются в комплекс с трилоном. Когда все свободные катионы металла будут связаны с трилоном, он вытеснит индикатор из неустойчивого металл-индикаторного комплекса:
![]() .
.
В результате окраска раствора изменяется, что позволяет установить эквивалентную точку.
Некоторые правила записи результатов анализа
Результат измерений и анализа выражают числом. Каждое такое число должно содержать только значащие цифры. Значащими являются все достоверно известные цифры числа плюс первая недостоверно известная цифра.
На аналитических весах масса взвешиваемого предмета измеряется с ошибкой ±0,0001 г. Следовательно, правильно записанное число должно содержать четыре цифры после запятой. Правильно: 7,3210 г; неправильно: 7,321 г.
Объём титранта, измеренный бюреткой, градуированной на 0,1 мл, должен быть выражен числом, содержащим две цифры после запятой. Правильно: 7,32 мл; неправильно: 7,3 мл.
Погрешность определений титриметрическими методами анализа колеблется в десятых долях процента. Следовательно, результат анализа при расчёте должен содержать четыре значащих цифры.
Примеры. Найденное содержание СаО в известняке: правильно: 0,2560 г; 51,45 %, неправильно: 0,256 г, 51,453 %.
Найденное значение концентрации: правильно – С= 0,1070 г/л, неправильно –С= 0,107 г/л.
Найденное значение титра: правильно – Т = 0,003901 г/мл, неправильно – Т = 0,0039012 г/мл.
Содержание отчёта
1. Название работы.
2. Цель работы.
3. Краткое описание метода анализа.
4. Результаты экспериментов.
5. Обработка результатов эксперимента.
6. Выводы.
Лабораторный практикум Лабораторная работа № 1 «Определение содержания железа весовым методом»
Цель работы: определить содержание железа в пробе раствора весовым методом.
Сущность работы.весовое
определение железа основано на реакции
![]() ,
которая приводит к образованию осаждаемой
формы железа. При прокаливании гидроксид
железа полностью переходит в весовую
форму:
,
которая приводит к образованию осаждаемой
формы железа. При прокаливании гидроксид
железа полностью переходит в весовую
форму:![]() .
В данном способе определения железа к
пробе раствора добавляют азотную кислоту
и нагревают на песчаной бане до кипения,
при этом происходит окисление железа
до трёхвалентного.
.
В данном способе определения железа к
пробе раствора добавляют азотную кислоту
и нагревают на песчаной бане до кипения,
при этом происходит окисление железа
до трёхвалентного.
Оборудование и реактивы: муфельная печь; аналитические весы; песчаная баня; фарфоровый тигель; химический стакан объёмом 100-150 мл; воронка; мерная пипетка объёмом 5 мл; беззольный фильтр марки «синяя лента»; стеклянная палочка с резиновым наконечником; азотная кислота, 2 н. раствор; гидроксид аммония, концентрированный раствор; проба раствора для анализа.
Выполнение работы
1. Из пробы раствора мерной пипеткой отобрать в химический стакан аликвоту объёмом 5 мл, добавить около 1 мл азотной кислоты и разбавить раствор в стакане дистиллированной водой до 50 мл. Раствор нагревать на песчаной бане почти до кипения.
2. вгорячий раствор при помешивании добавить избыток концентрированного раствора аммиака. Раствор с осадком нагревать ещё несколько минут и проверить полноту осаждения.
Проверка полноты осаждения. Дождаться оседания основной массы осадка гидроксида железа (III) на дно стакана. К раствору добавить несколько капель гидроксида аммония. Если в месте падения капли гидроксида аммония будет наблюдаться образование осадка гидроксида железа, то осаждение проведено не полностью. В этом случае к раствору следует добавить ещё осадителя.
3. Осадок количественно, без потерь, перенести на фильтр, стаканчик и палочку вытереть влажными кусочками фильтровальной бумаги, которые также поместить на фильтр. Осадок промыть на фильтре 2-3 раза горячей дистиллированной водой, в которую добавлено несколько капель раствора аммиака. Затем фильтр с осадком перенести в фарфоровый тигель, предварительно прокалённый до постоянного веса.
4. Осадок высушить на песчаной бане и озолить фильтр в муфельной печи при открытой дверце. Прокаливание ведут 40-60 минут при температуре 800-900°С. Тигель с оксидом железа охладить в эксикаторе над осушителем и взвесить на аналитических весах.
Содержание протокола лабораторной работы
Номер задачи.
Номер тигля.
Масса тигля с осадком.
Масса пустого тигля.
Обработка результатов эксперимента
Вычислить концентрацию железа (III) в пробе раствора:
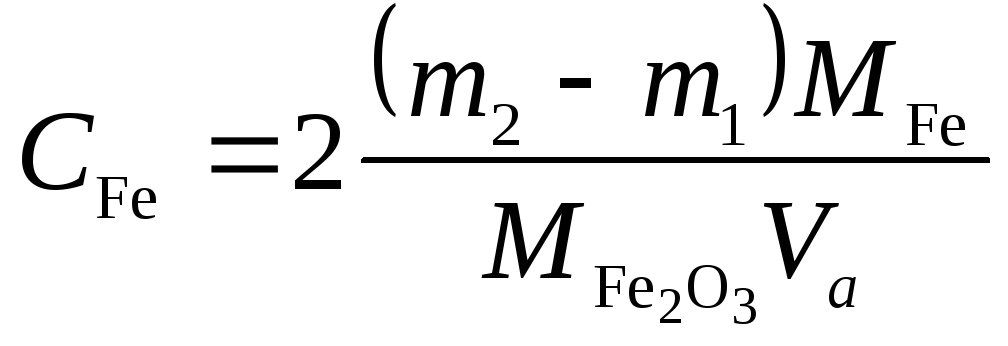 г/л,
г/л,
где
![]() и
и![]() ‒ массы пустого тигля и тигля с осадком,
г;
‒ массы пустого тигля и тигля с осадком,
г;![]() и
и![]() ‒
молярные массы железа и оксида
железа (III);
‒
молярные массы железа и оксида
железа (III);![]() ‒ объём аликвоты, л.
‒ объём аликвоты, л.
