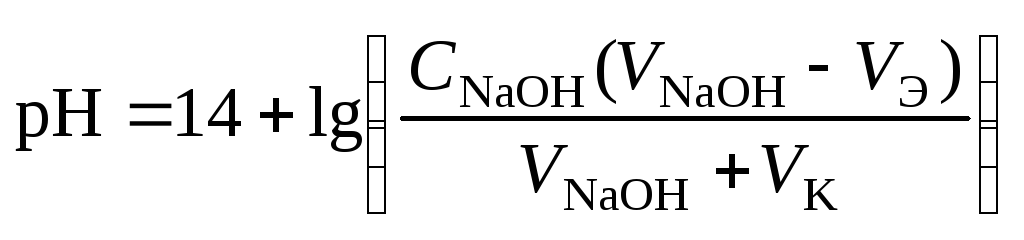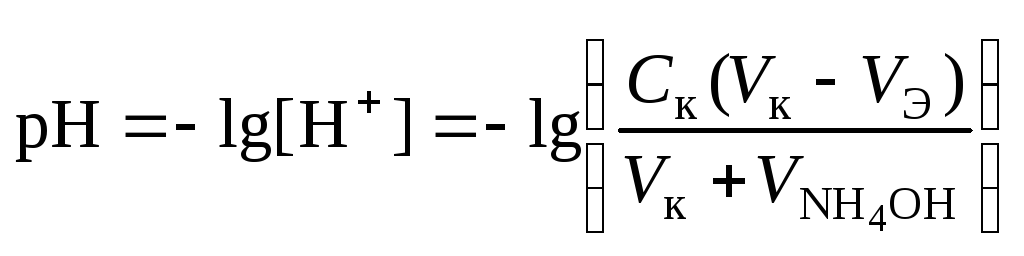- •Государственное образовательное учреждение высшего профессионального образования
- •Введение
- •Краткие теоретические сведения Весовой (гравиметрический) анализ
- •Метод отгонки
- •Метод выделения
- •Метод осаждения
- •Расчёты в гравиметрическом анализе Расчёт массы навески исследуемого вещества
- •Расчет объёма раствора осадителя
- •Расчеты результатов весового анализа при использовании метода осаждения
- •Объёмный (титриметрический) анализ
- •Понятия, применяемые для обработки результатов титрования
- •Расчеты в титриметрическом анализе
- •Кривые титрования
- •Кривая титрования сильной кислоты щёлочью
- •Кривая титрования сильного основания кислотой
- •Кривая титрования слабой одноосновной кислоты щёлочью
- •Кривая титрования слабого однокислотного основания сильной кислотой
- •Кривая титрования слабой многоосновной кислоты
- •Кривая титрования смеси сильной и слабой кислот
- •Кривая титрования раствора соли слабого электролита
- •Окислительно-восстановительное титрование
- •Комплексонометрия
- •Некоторые правила записи результатов анализа
- •Содержание отчёта
- •Лабораторный практикум Лабораторная работа № 1 «Определение содержания железа весовым методом»
- •Лабораторная работа № 2. «Определение содержания соды в присутствии щёлочи»
- •Лабораторная работа № 4. «Йодометрическое определение содержания меди»
- •Лабораторная работа № 5. «Определение содержания кальция и магния в совместном присутствии»
- •Лабораторная работа № 6. «Определение содержания цветных металлов трилонометрическим методом»
- •Задачи для решения
- •Литература
- •Содержание
Кривая титрования слабой одноосновной кислоты щёлочью
1 этап. В растворе присутствует только слабая кислота и рН раствора определяется её концентрацией и константой диссоциации:
![]() .
.
где СK– концентрация раствора кислоты, моль/л.
2 этап. Процесс титрования. Происходит постепенная нейтрализация кислоты щёлочью:
![]() .
.
В результате образуется буферная смесь, состоящая из слабой кислоты, избыток которой присутствует в системе до точки эквивалентности и соли этой кислоты. рН вычисляется по уравнению для кислого буферного раствора:
![]() ,
,
где
![]() – концентрация соли слабой кислоты,
– концентрация соли слабой кислоты,
![]() – остаточная концентрация слабой
кислоты,VK–
объём пробы кислоты, взятый для титрования,СЩ– концентрация раствора
щёлочи,VЩ–
объём раствора щёлочи, добавленный в
процессе титрования.
– остаточная концентрация слабой
кислоты,VK–
объём пробы кислоты, взятый для титрования,СЩ– концентрация раствора
щёлочи,VЩ–
объём раствора щёлочи, добавленный в
процессе титрования.
3 этап. Точка эквивалентности. На нейтрализацию кислоты затрачен эквивалентный объём щёлочи VЭ. В системе находится только соль, гидролизующаяся по аниону. рН в точке эквивалентности будет больше 7 и вычисляется по уравнению:
![]() .
.
Концентрация соли в точке эквивалентности:
![]() ,
,
где
![]() ‒ общий объём раствора в точке
эквивалентности,
‒ общий объём раствора в точке
эквивалентности,
![]() .
.
4 этап. После точки эквивалентности рН определяется только количеством добавленной щёлочи:
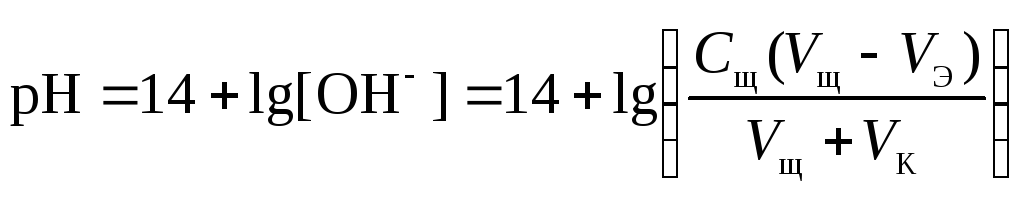 .
.
Пример. Рассчитать кривую титрования 10 мл 0,1 н. уксусной кислоты 0,1 н. раствором гидроксида натрия.
|
VNaOH, мл |
Система |
Расчётная формула |
рН |
|
0 |
0,1 н. раствор СН3СООН |
|
2,88 |
|
1 |
Титрование уксусной кислоты. |
Образование буферного раствора СН3СООН + СН3COONa:
|
3,80 |
|
5 |
4,76 | ||
|
7 |
5,12 | ||
|
9 |
5,71 | ||
|
9,5 |
6,03 | ||
|
9,9 |
6,75 | ||
|
10 |
Точка эквивалентности, VЭ= 10 мл,VΣ= 20 мл. |
Гидролиз соли СН3COONa:
|
8,88 |
|
10,1 |
Избыток щелочи |
|
10,70 |
|
11 |
11,68 | ||
|
12 |
11,96 | ||
|
15 |
12,30 | ||
|
20 |
12,52 |
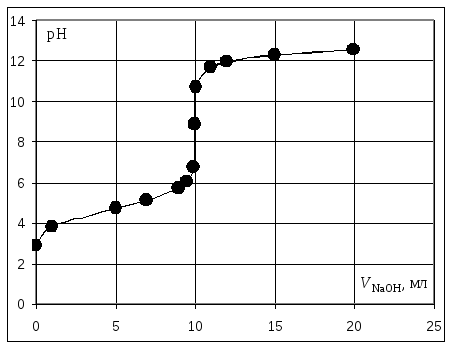
Кривая титрования слабой одноосновной кислоты щелочью
При рассмотрении кривой титрования обращает внимание то, что точка эквивалентности лежит в щелочной области. Скачок значений рН вблизи эквивалентной точки меньше, чем в случае сильного электролита и не превышает двух единиц рН при добавлении одной капли титранта. Для титрования следует выбирать индикатор, изменяющий окраску в щелочной среде, в примере – при рН = 8-9. Таковым является фенолфталеин.
Кривая титрования слабого однокислотного основания сильной кислотой
1 этап. В растворе присутствует только слабое основание и рН раствора определяется его концентрацией и константой диссоциации:
![]() .
.
где Со– концентрация раствора слабого основания, моль/л.
2 этап. Процесс титрования. Происходит постепенная нейтрализация слабого основания кислотой:
![]() .
.
В результате образуется буферная смесь, состоящая из слабого основания, избыток которого присутствует в системе до точки эквивалентности и соли этого основания. рН вычисляется по уравнению для основного буферного раствора:
![]() ,
,
где
![]() – концентрация соли слабого основания,
– концентрация соли слабого основания,
![]() – остаточная концентрация слабого
основания,VО– объём пробы
основания, взятый для титрования,Ск– концентрация раствора кислоты,VK– объём раствора кислоты, добавленный
в процессе титрования.
– остаточная концентрация слабого
основания,VО– объём пробы
основания, взятый для титрования,Ск– концентрация раствора кислоты,VK– объём раствора кислоты, добавленный
в процессе титрования.
3 этап. Точка эквивалентности. На нейтрализацию основания затрачен эквивалентный объём кислоты VЭ. В системе находится только соль, гидролизующаяся по катиону. рН в точке эквивалентности будет меньше 7 и вычисляется по уравнению:
![]() .
.
Концентрация соли в точке эквивалентности:
![]() ,
,
где
![]() ‒ общий объём раствора в точке
эквивалентности,
‒ общий объём раствора в точке
эквивалентности,
![]() .
.
4 этап. После точки эквивалентности рН определяется только количеством добавленной кислоты:
 .
.
Пример. Рассчитать кривую титрования 10 мл 0,1 н. гидроксида аммония 0,1 н. раствором соляной кислоты.
|
VNaOH, мл |
Система |
Расчётная формула |
рН |
|
0 |
0,1 н. раствор NH4OH |
|
11,12 |
|
1 |
Титрование уксусной кислоты |
Образование
буферного раствора NH4OH-NH4Cl
|
10,20 |
|
5 |
9,25 | ||
|
7 |
8,88 | ||
|
9 |
8,30 | ||
|
9,5 |
7,97 | ||
|
9,9 |
7,25 | ||
|
10 |
Точка эквивалентности, VЭ= 10 мл, VΣ= 20 мл |
Гидролиз соли NH4Cl:
|
5,12 |
|
10,1 |
Избыток кислоты |
|
3,30 |
|
11 |
2,32 | ||
|
12 |
2,04 | ||
|
15 |
1,70 | ||
|
20 |
1,48 |
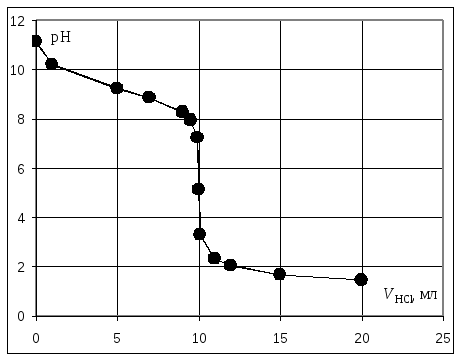
Кривая титрования слабого основания сильной кислотой
Кривая титрования слабого основания кислотой, например, раствора аммиака или его органического производного – амина, будет зеркальным отображением кривой титрования слабой одноосновной кислоты. Точка эквивалентности при этом окажется в кислой области. Для её определения необходим индикатор, изменяющий окраску в выбранном примере в области значений рН = 4-6, например, метиловый оранжевый.