
- •Влияние температуры
- •Влияние концентрации
- •Ядро атома
- •Изотопы
- •Характерные кристаллические решётки
- •15. Растворы
- •Значение понятия
- •Понижение температуры кристаллизации растворов
- •[Править]Повышение температуры кипения растворов
- •19. Гидролиз
- •Степень гидролиза
- •20. Гидролиз солей многоосновных кислот и оснований
- •22. Понятие о протолизе
- •Вывод значения ионного произведения воды
- •Реакция ионного обмена — одна из видов химической реакции, характеризующаяся выделением в продукты реакции воды, газа илиосадка. Изображение реакций ионного обмена
- •Правила написания реакций двойного обмена
- •2. Если в результате реакции выделяется нерастворимое в воде вещество.
- •3. Если в результате реакции выделяется газообразное вещество.
- •Реакция нейтрализации
- •24. Виды окислительно-восстановительных реакций
- •[Править]Вывод уравнения Нернста
- •Первый закон Фарадея
- •Вывод закона Фарадея
- •Второй закон Фарадея
Закон сохранения массы вещ-ва: Масса вещ-в, вступивших в химическую реакцию, равна массе вещ-в, образовавшихся в результате реакции. NaOH + HNO3 = NaNO3 + H2O (m1 +m2) = (m3 + m4)
m1 m2 m3 m4
Закон Авогадро: в равных объемах различных газов в одинаковых условиях содержится одинаковое число молекул. NA – число Авогадро.
NA=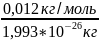 =6,02
*1023
=6,02
*1023
При одинаковых условиях, 1 моль любого газа занимает одинаковый объем (22,4 л/моль), при t=273К и Р= 101,3 кПа. Вывод: при нормальных условиях 1 моль различных газов занимает объем 22,4.
Моля́рный объём — объём одного моля вещества. Согласно закону Авогадро, 1 моль любого газа при нормальных условиях имеет один и тот же объём Vm = 22,413 996(39) л
Относительная плотность газа по второму равна отношению их молярных масс.
Теоретическая плотность любого газа: ρ = М(г)/ 22,4 (л), г/л
ρ(Cl2) = (35,45 x 2) : 22,4 = 3,165 г/л
ρ1
=
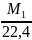 ρ1
=
ρ1
=
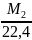
 =
=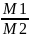 =D2
(1) D2(1)
= М1
: М2
, откуда М1
= М2
х D2(1)
=D2
(1) D2(1)
= М1
: М2
, откуда М1
= М2
х D2(1)
Пример: относительная плотность газа по водороду равна 22. Тогда:
M1 = 2 x DH (1) = 2x 22 = 44. Возможно это CO2.
Моль – кол-во вещества, которое содержит столько же структурных единиц, сколько атомов в 0,012 кг изотопа углерода 12С
Молярная масса вещества – отношение массы вещества к кол-ву вещества.
М= г/моль
г/моль
Эквивалент – реальная и условная единица вещ-ва, эквивалентная
-одному иону водорода в кислотно основных и ионообменных реакциях
-одному электрону в окислительно-восстановительных реакциях
Реальные частицы: атомы, ион, молекулы.
Масса моль эквивалента:
Элемента в соединении Мэ(элем) = М/В
М – атомная масса элем. В – валентность
Оксида: ЭхОy
Мэ(оксида)
=
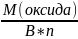 ,
г/моль – экв.
,
г/моль – экв.
N –число атомов в молекуле
абсолютная плотность газа - Это его плотнось в еденице объёма
А относительная(D) - это число, показывающее отношение плотности данного вещества(газа) к плотности другого.
Оксиды – это соединения двух элементов, один из которых кислород:
Основными ( Me I, II: Na2O, CaO) называются оксиды, которым соответствуют основные гидроксиды.
Кислотными (HMe IV, CO2 V, P2O5 VI) называются оксиды, которым соответствуют кислоты.
Амфотерными (ZnO, Fe2O3 , Cr2O3, Al2O3, BeO) называют оксиды, которые в зависимости от условий проявляют основные или кислотные свойства.
Гидроксиды Me(OH)m – сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксильных групп –OH. Растворимые в воде (щелочи) – NaOH, нерастворимые в воде основания – Cu (OH)2, амфотерные основания: Zn (OH)2. входит одна группа –ОН, то оно называется однокислотным, если 2 группы – двухкислотным и т.д. Делятся на основные (все ост.) и амфотерные ( Zn(OH)2, Al(OH)3, Fe(OH)3, Cr(OH)3, Be(OH)2)
Кислоты (HKO) – сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на металл, и кислотного остатка. Если в состав молекулы кислоты входит один атом водорода, она называется одноосновной (HCl, HNO3), если два и более – многоосновной (H2SO4). Кислоты бывают бескислородными (HCl, H2S) и кислородными (H3PO4) .
Соли – сложные вещества, которые являются продуктами замещения атомов водорода в молекулах кислот атомами металла или гидроксильных групп в молекулах оснований кислотными остатками. Соли средние образованы путем замены всех атомов соли в кислоте атомами металлов.
Соли кислые образованы при неполной замене ионов кислоты атомами.
Соли основные образованы при неполной замене –OH – групп основания кислотным остатком.
Химические свойства: 1. ОКСИДЫ. Основных оксидов: взаимодействуют с водой, кислотными оксидами, с кислотой. 2. Кислотные: с водой с образованием кислоты, с основными оксидами, с основаниями. 3. Амфотерные: с основаниями, кислотами. II. ГИДРОКСИДЫ 1. Основные: а) с кислотным оксидом, б) с кислотой; 2. Амфотерные: а) с основными основаниями, б) кислотой. 3. КИСЛОТЫ: с металлами, с основными оксидами, с основаниями.
СОЛИ: Кислотами HCl, основаниями CaO, солями Na2SO4 NaCl CaSO4
Состояние системы характеризуется термодинамическими параметрами. Термодинамика – наука, изучающая переходы энергии между системой и окр. средой.
Объектом термодинамики является система.
Система – это совокупность объектов, которые мысленно или физически обособлены от окр.среды.
Системы различаются на 3 группы :Изолированные ,Закрытые, Открытые. Системы делятся на: Гомогенные, Гетерогенные. Любая система характеризуется термодинамическими параметрами:
-температура (Т) -давление (Р) -концентрация (с)
Параметры состояния (термодинамич. ф-и): внутренняя энергия (U), энтальпия (H), энтропия (S), энергия Гиббса (G)
Внутренняя энергия включает в себя все виды энергии системы, кроме кинетической энергии движения системы и потенциальной энергии ее положения. ΔU = U2 – U1
Энтальпия – мера энергии, которую накапливает вещество при его образовании.
Стандартная энтальпия образования – тепловой эффект реакций образования 1 моль вещества из простых веществ, устойчивых при 298К и давлении 101,3 кПа. Энтальпия образования простых веществ равна нулю.
Энтропия – мера беспорядка. Система стремится самопроизвольно перейти от порядка к беспорядку. Беспорядок в системе обусловлен хаотичным движением молекул.
S = k x ln W
W- термодинамическая вероятность системы
К – постоянная Больцмана
В изолированной системе реакция протекает в сторону увеличения энтропии. Если ΔS>0, реакция возможна, ΔS <0 – реакция не идет.
Энергия Гиббса Δ G – изобарно-изотермический потенциал. Δ G = ΔH – TΔS, T = 298K
Δ G < 0 – прямая химическая реакция возможна
Δ G > 0 – может протекать обратная реакция
Δ G = 0 – состояние равновесия
Закон Гесса. Тепловой эффект реакции не зависит от числа промежуточных стадий, а определяется лишь начальным и конечным состоянием системы.
Сграффит + О2(г) = СО2 (г) Δ Н = -393,5 кДж/моль
Следствие из закона Гесса: стандартный тепловой эффект химической реакции равен сумме стандартных теплот образования продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ с учетом стехиометрических коэффициентов.
aA + bB = dD + eE A и В – исходные вещества D и Е – продукты реакции
а, b, d, e – стехиометрич. коэф.
Расчет теплового эффекта: Δ Н= ∑ 𝛎 ΔН(продуктов) - ∑ 𝛎 ΔН(исходных веществ)
Эндотермические реакции— химические реакции, сопровождающиеся поглощением теплоты. Для эндотермических реакций изменение энтальпии и внутренней энергии имеют положительные значения (ΔH > 0, ΔU > 0). Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты.
Самопроизвольным называется процессы, которые происходят без подвода энергии из вне.
Для самопроизвольно протекающих процессов ΔG < 0. Для определения направления процесса в системе достаточно рассчитать эту величину: ΔG = ∑(𝛎 ΔG)прод. - ∑(𝛎 ΔG)исходных или ΔG = ΔH – T ΔS. Изменение энергии Гиббса (ΔG = ∑(𝛎 ΔG)прод. - ∑(𝛎 ΔG)исходных или ΔG = ΔH – T ΔS ) отвечает на вопрос о принципиальной возможности или невозможности протекания процесса в данных условиях.
В изолированных системах реакция протекает в сторону увеличения энтропии. Если ΔS> 0 реакция возможна, ΔS < 0 реакция не идет. Для открытой и закрытой систем критерием возможности протекания самопроизвольного процесса является энергия Гиббса. ΔG <0 – прямая химическая реакция возможна, ΔG>0 – может протекать обратная реакция, ΔG = 0 – состояние равновесия.
Первое начало термодинамики: Q = ΔU + A (теплота, подведенная к системе, расходуется на приращение внутренней энергии и на работу системы против действия внешних сил)
2й: A = pSh, Sh = ΔV = V2 - V1 , A = p(V2 – V1) = pΔV, Qp = ΔU + pΔV, Qp = (U2 – U1) + p(V2 – V1) = U2-U1+pV2-pV1 = (U2 + pV2) – (U1 + pV1), U+pV = H – энтальпия, U2 + pV2 = H2 – энтальпия конечного сост.,U1 + pV1 = H1 – энтальпия начального сост. В изобарных условиях: (p = const) Qp = H2 – H1 = ΔH
Первый закон (первое начало) термодинамики - это, фактически, закон сохранения энергии. Он утверждает, что
энергия изолированной системы постоянна. В неизолированной системе энергия может изменяться за счет: а) совершения работы над окружающей средой; б) теплообмена с окружающей средой.
Для описания этих изменений вводят функцию состояния - внутреннюю энергию U и две функции перехода - теплоту Q и работу A. Математическая формулировка первого закона:
dU = ![]() Q -
A (дифференциальная
форма) (2.1)
Q -
A (дифференциальная
форма) (2.1)
![]() U = Q - A (интегральная
форма) (2.2)
U = Q - A (интегральная
форма) (2.2)
Буква в уравнении (2.1) отражает тот факт, что Q и A - функции перехода и их бесконечно малое изменение не является полным дифференциалом.
В уравнениях (2.1) и (2.2) знаки теплоты и работы выбраны следующим образом. Теплота считается положительной, если она передается системе. Напротив, работа считается положительной, если она совершается системой над окружающей средой.
Второй закон термодинамики устанавливает критерии необратимости термодинамических процессов. Известно много формулировок второго закона, которые эквивалентны друг другу. Мы приведем здесь только одну формулировку, связанную с энтропией.
Существует функция
состояния -
энтропия S,
которая обладает следующим свойством: ![]() ,
(4.1) где знак равенства относится к
обратимым процессам, а знак больше - к
необратимым.
,
(4.1) где знак равенства относится к
обратимым процессам, а знак больше - к
необратимым.
Для изолированных систем второй закон утверждает: dS і 0, (4.2) т.е. энтропия изолированных систем в необратимых процессах может только возрастать, а в состоянии термодинамического равновесия она достигает максимума (dS = 0, d 2S < 0).
Неравенство (4.1) называют неравенством Клаузиуса. Поскольку энтропия - функция состояния, ее изменение в любом циклическом процессе равно 0, поэтому для циклических процессов неравенство Клаузиуса имеет вид:
![]() ,
(4.3)
,
(4.3)
где знак равенства ставится, если весь цикл полностью обратим.
Скорость химических реакций – это кол-во элементарных актов взаимодействия в единицу времени в единице пространства.
Раздел химии, который изучает скорость химических реакций и влияние на нее различных термодинамических параметров (Т,Р,с)
Скорость химической реакции равна изменению концентрации в единицу.
В
гомогенной системе для реакции
А + В = АВ ʋ̅ =
-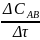 =
=
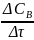 =
=
ʋ̅
= ±
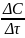 ,
,
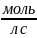 ʋ̅1
=
ʋ̅1
=
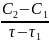 = -
ʋ̅2
=
= -
ʋ̅2
=
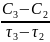 = -
= -
для
определения истинной скорости ʋ = ±
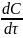 dτ
0
dτ
0
В гетерогенной системе: С(т) + О2(г) = СО2(г)
ʋ̅
= ±
 Cs
– поверхностная концентрация.
Cs
– поверхностная концентрация.
Скорость химических реакций зависит от: 1) от химической природы реагирующих веществ 2) концентрации компонентов 3) температуры системы 4) присутствия катализатора 5) внешних воздействий и пр.
Закон действия масс: при постоянной t ʋ химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам в уравнениях реакции.
Для реакций типа А + 2В АВ2
Кинетическое уравнение ʋ = к [CA]2 [CB]2
Физический смысл параметра константы скорости химической реакции ʋ = к [CA]a [CB]b если CA = CB = 1, значение к=ʋ
Константа скорости химических реакций равна скорости химической реакции при концентрации реагирующих веществ, равных 1.
к≠f(C), k = f(T)
Правило
Вант-Гоффа:
скорость химической реакции при повышении
температуры на 10⁰ возрастает от 2х до
4х раз.
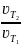 =
=
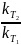 = ϒ
= ϒ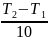 =
ϒ
=
ϒ
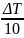
Физический смысл ϒ - Увеличение или уменьшение сопротивления при повышении или понижении температуры
Энергия активации – энергия, необходимая для образования переходного комплекса.
А В А….В А --- В
I + I : : = 2АВ
А В А....В А --- В
Переходное состояние (актив. комплекс) – состояние, при котором связи в исходных веществах еще не разорваны, но ослаблены, а в продуктах реакции еще наметились, но не окрепли.
Уравнение Аррениуса: k = A e( - EA/RT), к – константа скорости химич. реакции
А – множитель; е = 2,7 , R – газовая постоянная = 8,31 Дж/моль К
ЕА – энергия активации (для хим. Реакций ЕА от 40 до 400 кДж/ моль)
Ln
k = lnA -
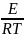 = ln A -
= ln A -
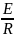
 y = a – bx; b =
ln k = f (
)
tgϕ =
y = a – bx; b =
ln k = f (
)
tgϕ =
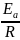 Ea
= tg ϕ R
Ea
= tg ϕ R
A = pz z – число столкновений частиц в секунду; p – отношение числа благоприятных ориентаций молекул к общему числу.
В гомогенной системе для реакции А + В = АВ ʋ̅ = - = =
ʋ̅ = ± , ʋ̅1 = = - ʋ̅2 = = -
для определения истинной скорости ʋ = ± dτ 0
В гетерогенной системе: С(т) + О2(г) = СО2(г)
ʋ̅ = ± Cs – поверхностная концентрация.
Катализаторы и каталитические системы.
Катализаторы – вещ-ва, изменяющие скорость химических реакций.
Увеличивают константу скорости хим. Реакции
Ускоряют достижение равновесия
Не влияют на выход продуктов реакции.
Виды катализа: гомогенный: вещ-ва и катализатор – одна фаза
Гетерогенный: вещ-ва и катализатор в разных фазах.
Реакция без катализатора: А + В = АВ; реакция с катализатором: 1. А + к ( 1 ) (реакция с низким уровнем энергии активации) 2. АК + В = АВ + к ( 2 ) (реакция энергии активации невелика)
Сумма энергии активации обеих реакций меньше, чем энергия активации главной реакции.
Гомогенный катализ: окисление SO2 в SO3 (катализатор NO)
NO + 1/2O2 = NO2 SO2 + NO2 = SO3 + NO3
Гетерогенный катализ – его эффективность зависит от площади поверхности катализа.
А) влияние поверхности: процесс разложения H2O2 H2O + 1/2О2
Полированная: - нет разложения H2O2 , шероховатая – заметное выделение О2 , порошок – энергичное выделение О2, коллоидная – разложение со взрывом.
Шероховатая поверхность катализатора имеет шероховатую поверхности и больше активных центров, на которых и протекает химическая реакция.
Реагирующие вещества находятся в большом объеме, сорбированных на поверхности, концентрация резко увеличивается.
Т.к. скорость химической реакции пропорциональна концентрации реагирующих веществ, то процесс резко ускоряется.
7. Закон действия масс: при постоянной t ʋ химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам в уравнениях реакции.
Правило Вант-Гоффа: скорость химической реакции при повышении температуры на 10⁰ возрастает от 2х до 4х раз. (эту величину называют температурным коэффициентом реакции). = = ϒ = ϒ ϒ – температурный коэффициент скорости химической реакции.
Зависимость скорости реакции от присутствия катализатора: Катализаторы - это вещества, которые повышают скорость химической реакции. Увеличивают константу скорости хим. Реакции
Ускоряют достижение равновесия
Не влияют на выход продуктов реакции.
Влияние концентрации: закон действия масс . Для реакций типа А + 2В АВ2
Кинетическое уравнение ʋ = к [CA]2 [CB]2
Зависимость скорости реакции от температуры определяется правилом Вант – Гоффа.
От давления: N2 + 3H2 = 2NH3. При увеличении давления в системе в 3 раза: ʋ2 = k [3 (CN2)] * [3 (CH2)]3= 81k [ (CN2)] * [ (CH2)]3, скорость реакции возрастает в 81 раз. Увеличением давления можно ускорить хим.реакцию, если в системе есть хотя бы одно газообразное вещество.
8. Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
Например для реакции:
![]()
выражение для скорости будет выглядеть так:
![]() .
.
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени.
Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
природа реагирующих веществ,
наличие катализатора,
температура (правило Вант-Гоффа),
давление,
площадь поверхности реагирующих веществ.
Состояние системы, при котором Vпрям. = Vобр. называется химическим равновесием. Равенство скоростей прямой и обратной реакций является кинетическим условием химического равновесия. Термодинамическим условием химического равновесия является условие ∆G=0
9. Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:
3H2 + N2 ⇌ 2NH3.
Направление обратимых реакций зависит от концентраций веществ — участников реакции. Так в приведённой реакции, при малой концентрацииаммиака в газовой смеси и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции.
Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость. Например, простая реакция
N2O4 ⇌ 2NO2
складывается из элементарных реакций
N2O4 ⇌ 2NO2 и 2NO2 ⇌ N2O4.
Для обратимости сложной (многостадийной) реакции, например уже упоминавшейся реакции синтеза аммиака, необходимо, чтобы были обратимы все составляющие её стадии.
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.
Ba(ClO2)2 + H2SO4 → 2HClO2 + BaSO4↓
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Однако надо понимать, что при изменении условий протекания реакции, теоретически возможно сместить равновесие любой реакции.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причёмскорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрацииреагентов, температура и другие параметры системы не изменяются со временем.[1]
А2 + В2 ⇄ 2AB
В состоянии равновесия скорости прямой и обратной реакции становятся равными.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями(либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции. Расчётные методы определения константы равновесия реакции обычно сводятся к вычислению тем или иным способом стандартного изменения энергии Гиббса в ходе реакции (ΔG0), а затем использованию формулы:
![]()
Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Влияние температуры
Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры. Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа:
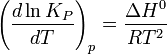
в системах с газовой фазой — уравнением изохоры Вант-Гоффа
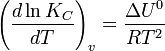
В небольшом диапазоне температур в конденсированных системах связь константы равновесия с температурой выражается следующим уравнением:
![]()
Например, в реакции синтеза аммиака
N2 + 3H2 ⇄ 2NH3 + Q
тепловой эффект в стандартных условиях составляет +92 кДж/моль, реакция экзотермическая, поэтому повышение температуры приводит к смещению равновесия в сторону исходных веществ и уменьшению выхода продукта.
Влияние давления
Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам:
При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
В реакции синтеза аммиака количество газов уменьшается вдвое: N2 + 3H2 ↔ 2NH3
Значит, при повышении давления равновесие смещается в сторону образования NH3, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C:
Влияние концентрации
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
10. Химический элемент - это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. В настоящее время известно 110 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем.
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A =Z + N.
Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
