
- •1. Расчет ионной силы раствора Краткие теоретические сведения
- •Примеры решения задач Пример 1.
- •Задачи для решения
- •2. Кислотно-основные свойства растворов электролитов
- •2.1. Равновесия в растворах сильных кислот и оснований
- •2.1.1. Расчет рН в растворах сильных кислот и оснований
- •Пример 4.
- •Задачи для решения
- •2.2. Равновесия в растворах слабых кислот и оснований
- •2.2.1. Расчет рН в растворах слабых кислот и оснований
- •Пример 11.
- •Задачи для решения
- •2.3.1. Расчет рН в растворе гидролизующейся соли
- •Пример 14.
- •2.3.3. Расчет равновесного ионно-молекулярного состава гидролизующейся соли
- •Пример 16.
- •2.4. Равновесия в буферных растворах
- •Пример 17.
- •Задачи для решения
- •3. Равновесия в насыщенных растворах
- •3.1. Общие сведения
- •3.2. Растворимость в бинарной системе соль - вода
- •Пример 22.
- •3.3. Растворимость в многокомпонентной системе с индифферентным электролитом
- •Пример 23
- •Пример 24.
- •3.4. Растворимость в многокомпонентной системе с одноименными ионами
- •Пример 25.
- •Задачи для решения
2.2. Равновесия в растворах слабых кислот и оснований
2.2.1. Расчет рН в растворах слабых кислот и оснований
Слабые кислоты и основания в водных растворах диссоциированы не полностью и основная масса вещества существует в растворе в молекулярной форме. Процесс диссоциации слабого электролита протекает ступенчато. Например, для слабой двухосновной кислоты H2An:
![]() –первая ступень
диссоциации;
–первая ступень
диссоциации;
![]() –вторая ступень
диссоциации.
–вторая ступень
диссоциации.
Основной количественной характеристикой силы слабого электролита является константа равновесия процесса диссоциации или константа диссоциации. Каждая ступень диссоциации характеризуется своей константой равновесия. Для слабой двухосновной кислоты H2Anсуществует две константы диссоциации:
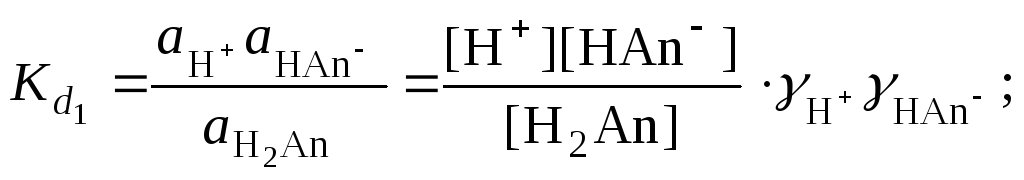
![]()
Значения констант диссоциации для 25°С приводятся в справочной литературе
Обычно константа диссоциации по второй ступени приближенно в 104-105раз ниже, чем по первой. По третьей ступени константа диссоциации еще во столько же раз ниже. Поэтому при расчетах рН в растворах многоосновных слабых кислот обычно учитывают только первую ступень диссоциации, пренебрегая второй и третьей ступенями.
![]() и
(2.15)
и
(2.15)
![]() ,
(2.16)
,
(2.16)
где
![]() – первая константа диссоциации слабого
электролита,СкиСщмолярные концентрации
кислоты и, соответственно, щелочи.
– первая константа диссоциации слабого
электролита,СкиСщмолярные концентрации
кислоты и, соответственно, щелочи.
Пример 11.
Вычислить рН раствора гидроксида аммония
концентрацией 0,5 моль/л;
![]()
Решение. 1. Записать уравнение диссоциации гидроксида аммония
![]()
2. Вычислить концентрацию гидроксид-ионов в растворе аммиака в воде
![]()
и величину рН (полагая
![]() )
)
![]()
Задачи для решения
IV. Определить pH предложенного раствора слабого электролита при температуре 25°
|
№ |
Электролит |
Концентрация |
dр-ра, г/см3 |
|
|
NH4OH |
2 % |
0,989 |
|
|
CH3COOH |
0,12 % |
1,0 |
|
|
HCOOH |
4,5 % |
1,01 |
|
|
CH3COOH |
2 % |
1,001 |
|
|
NH4OH |
2,35 % |
0,988 |
|
|
C6H5NH3OH |
93,02 г/л |
- |
|
|
N2H5OH |
5 % |
1,01 |
|
|
C6H5OH |
5 % |
1,02 |
|
|
HCOOH |
0,5 % |
- |
|
|
CH3COOH |
0,65 % |
- |
|
|
HNO2 |
0,8 % |
- |
|
|
HCN |
2,7 % |
1,01 |
|
|
C6H5OH |
9,4 г/л |
- |
|
|
NH4OH |
0,1 % |
- |
|
|
HCN |
8 % |
1,04 |
|
|
HCOOH |
2,3 % |
1,005 |
|
|
CH3COOH |
1 % |
- |
|
|
NH4OH |
0,34 % |
1,0 |
|
|
HCOOH |
3 % |
1,007 |
|
|
H2S |
0,32 н. |
|
|
|
NH4OH |
0,5 % |
1,0 |
|
|
H3PO4 |
1 % |
1,005 |
|
|
C9H6NH2OH |
3 г/л |
|
|
|
Лимонная к-та |
120 г/л |
|
|
|
Бензойная к-та |
2 % |
1,003 |
|
|
N2H5OH |
0,5 % |
|
|
|
HCOOH |
4 % |
1,01 |
|
|
C6H5NH2OH |
0,56 г/л |
|
|
|
CH4NH2OH |
24,5 г/л |
|
|
|
C3H8NH2OH |
23,1 г/л |
|
|
|
C4H10NH2OH |
13,65 г/л |
|
|
|
C5H12NH2OH |
1 г/л |
|
|
|
C2H5NH2OH |
0,5 г/л |
|
|
|
HNO2 |
2 % |
1,01 |
|
|
Винная к-та |
1 % |
1,02 |
|
|
H3BO3 |
5 % |
1,03 |
|
|
HBrO |
0,1 % |
1,0 |
|
|
H3BO3 |
10 % |
1,04 |
|
|
C6H5OH |
6,5 г/л |
|
|
|
H2S |
10 г/л |
|
|
|
H2CO3 |
8 % |
1,05 |
|
|
HF |
6 % |
1,03 |
|
|
C7H8NH2OH |
5 г/л |
|
|
|
NH2OHH2O |
6,2 г/л |
|
|
|
H3BO3 |
1,5 % |
1,01 |
|
|
C2H6NHOH |
2 г/л |
|
|
|
C4H10NHOH |
2,8 г/л |
|
|
|
C3H9NOH |
3 г/л |
|
|
|
C2H6ОNHOH |
1,6 г/л |
|
|
|
CS(NH2)2·H2O |
20 г/л |
|
|
|
NH4OH |
3 % |
0,989 |
|
|
CH3COOH |
1,2 % |
1,0 |
|
|
HCOOH |
5 % |
1,01 |
|
|
CH3COOH |
5 % |
1,001 |
|
|
NH4OH |
2,5 % |
0,988 |
|
|
C6H5NH3OH |
100 г/л |
- |
|
|
N2H5OH |
6,5 % |
1,01 |
|
|
C6H5OH |
5 % |
1,02 |
|
|
HCOOH |
0,5 % |
- |
|
|
CH3COOH |
0,65 % |
- |
