
- •1. Расчет ионной силы раствора Краткие теоретические сведения
- •Примеры решения задач Пример 1.
- •Задачи для решения
- •2. Кислотно-основные свойства растворов электролитов
- •2.1. Равновесия в растворах сильных кислот и оснований
- •2.1.1. Расчет рН в растворах сильных кислот и оснований
- •Пример 4.
- •Задачи для решения
- •2.2. Равновесия в растворах слабых кислот и оснований
- •2.2.1. Расчет рН в растворах слабых кислот и оснований
- •Пример 11.
- •Задачи для решения
- •2.3.1. Расчет рН в растворе гидролизующейся соли
- •Пример 14.
- •2.3.3. Расчет равновесного ионно-молекулярного состава гидролизующейся соли
- •Пример 16.
- •2.4. Равновесия в буферных растворах
- •Пример 17.
- •Задачи для решения
- •3. Равновесия в насыщенных растворах
- •3.1. Общие сведения
- •3.2. Растворимость в бинарной системе соль - вода
- •Пример 22.
- •3.3. Растворимость в многокомпонентной системе с индифферентным электролитом
- •Пример 23
- •Пример 24.
- •3.4. Растворимость в многокомпонентной системе с одноименными ионами
- •Пример 25.
- •Задачи для решения
3.3. Растворимость в многокомпонентной системе с индифферентным электролитом
В этом случае расчет растворимости сводится к влиянию ионной силы раствора на растворимость трудно растворимого соединения. Ионную силу раствора следует вычислять, ориентируясь на соотношение концентраций в растворе трудно растворимой соли и соли, содержащей одноименный ион.
Если разница между ними не велика, то в уравнении ионной силы следует учитывать все ионные компоненты раствора. Если концентрация электролита, содержащего одноименный ион, в 10 и более раз превышает растворимость осадка, то значением растворимости при расчете ионной силы раствора можно пренебречь.
Пример 23
Рассчитать растворимость Ag2SO4в растворе нитрата натрия, концентрацией 0,1 моль/кг, если его растворимость в воде составляет 0,0228 моль/кг.
Решение. 1. Вычислить ионную силу раствора, содержащего сульфат серебра и нитрат натрия
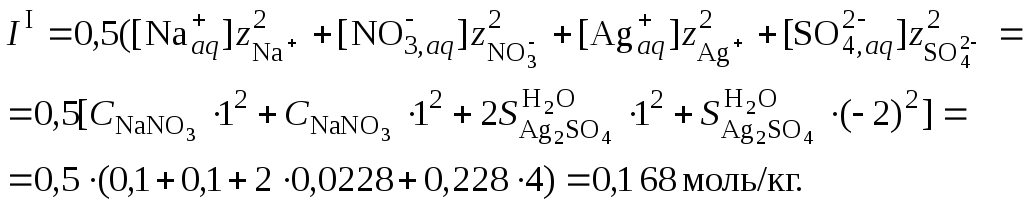
2. Вычислить средний ионный коэффициент активности сульфата серебра
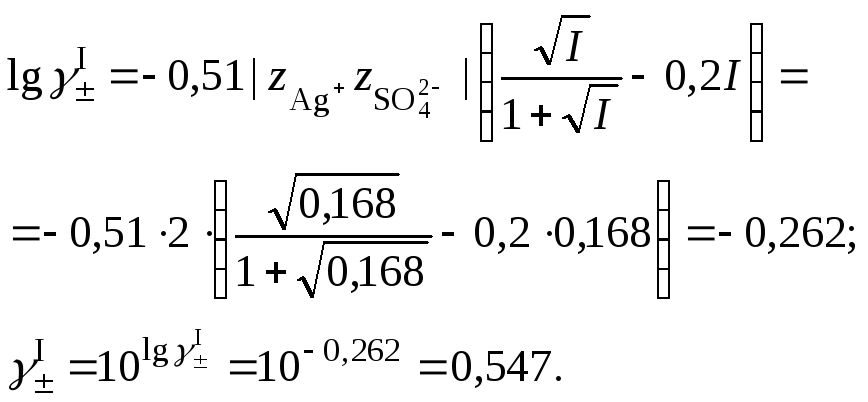
3. Вычислить растворимость сульфата серебра в присутствии нитрата натрия
![]()
4. Пересчитать ионную силу раствора с учетом растворимости сульфата серебра, вычисленной в п. 3
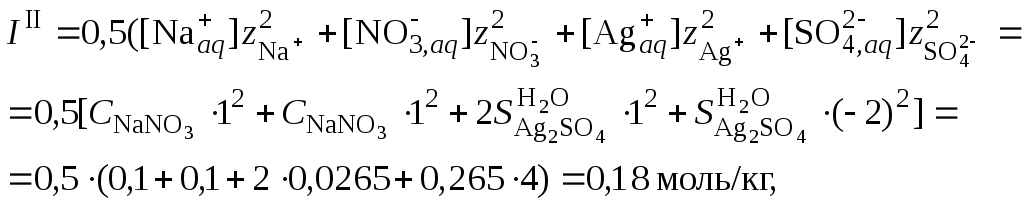
средний ионный коэффициент активности сульфата серебра
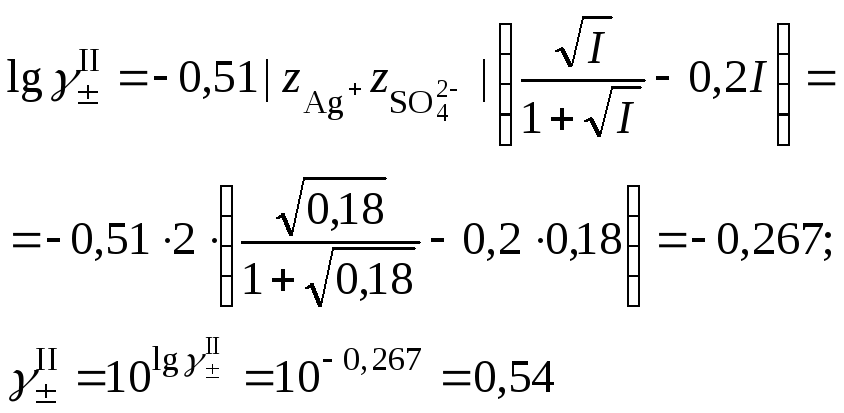
и растворимость сульфата серебра в присутствии нитрата натрия
![]()
5. ![]() ,
следовательно, следует повторить
пересчет ионной силы раствора, коэффициента
активности и растворимости
,
следовательно, следует повторить
пересчет ионной силы раствора, коэффициента
активности и растворимости
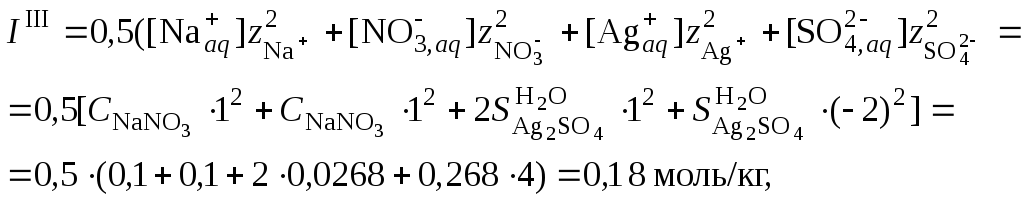
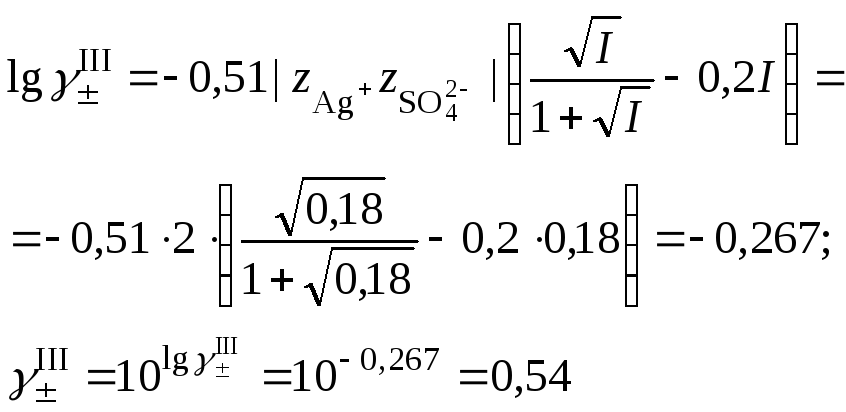
![]()
6.
![]() и окончательное значение растворимости
сульфата серебра в растворе нитрата
натрия составляет 0,0268 моль/кг.
и окончательное значение растворимости
сульфата серебра в растворе нитрата
натрия составляет 0,0268 моль/кг.
Полученное значение растворимости сульфата серебра в присутствии постороннего электролита превышает найденное для бинарной системы сульфат серебра – вода (0,0228 моль/кг). При повышении ионной силы раствора растворимость малорастворимого соединения должна увеличиваться, что согласуется с полученными расчетными данными.
Пример 24.
Вычислить растворимость сульфата бария (L= 10–10) в растворе хлорида кальция концентрацией 0,1 моль/кг.
Решение. 1. Составить уравнение растворимости сульфата бария
![]() ,
,
его произведение растворимости
![]()
и вычислить ориентировочное значение растворимости сульфата бария в воде
![]()
2. Вычислить ионную силу раствора, содержащего сульфат бария и хлорид кальция. Очевидно, что ионная сила раствора будет определяться только концентрацией индифферентного электролита
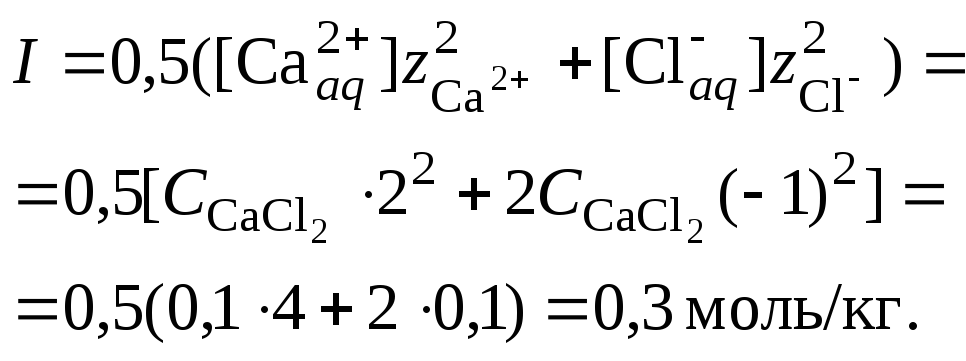
3. Вычислить средний ионный коэффициент активности сульфата бария
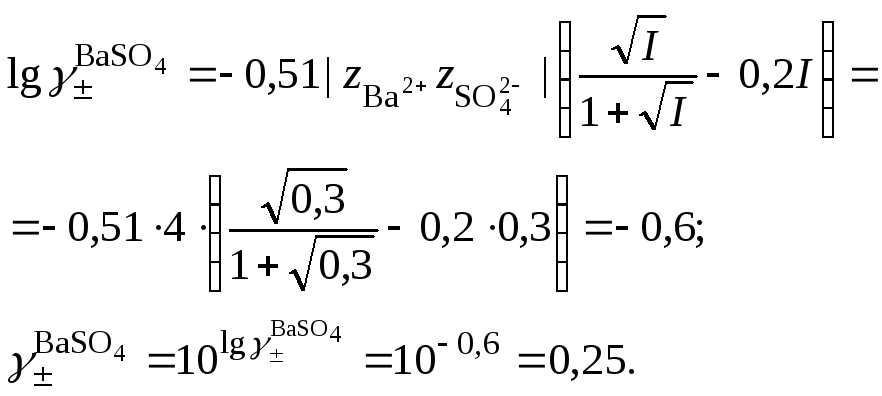
4. Рассчитать растворимость сульфата бария в присутствии хлорида кальция
![]()
3.4. Растворимость в многокомпонентной системе с одноименными ионами
В этом случае раствор содержит, помимо
трудно растворимой соли, другой сильный
электролит, как правило, хорошо растворимую
соль, имеющий в своем составе одноименные
с составом осадка ионы, например:
![]() или
или![]() .
.
В этом случае при составлении уравнения закона действующих масс следует учитывать, что концентрация катиона или аниона может складываться из нескольких источников.
В присутствии одноименного аниона
![]() уравнение закона действующих масс
уравнение закона действующих масс
![]() .
(3.12)
.
(3.12)
Например, уравнение закона действующих
масс для системы
![]() :
:
![]()
В присутствии одноименного катиона
![]()
![]() .
(3.13)
.
(3.13)
Например, уравнение закона действующих
масс для системы
![]() :
:
![]()
В обоих случаях приходится решать степенное уравнение второго или более высокого порядка.
Ионную силу раствора в присутствии одноименного иона следует вычислять, ориентируясь на соотношение концентраций в растворе трудно растворимой соли и соли, содержащей одноименный ион.
Если разница между ними не велика, то в уравнении ионной силы следует учитывать все ионные компоненты раствора. Если концентрация электролита, содержащего одноименный ион, в 10 и более раз превышает растворимость осадка, то значением растворимости при расчете ионной силы раствора можно пренебречь.
Следует запомнить, что растворимость в присутствии одноименных ионов всегда понижается.
