
Министерство образования Республики Беларусь
МОГИЛЕВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПРОДОВОЛЬСТВИЯ
Кафедра химической технологии высокомолекулярных соединений
Синтез уксусноизоамилового эфира
Лабораторная работа № 1
по дисциплине “Органическая химия”
Специальность 1- 49 01 02 “Технология хранения и переработки
животного сырья”
Специализация 1- 49 01 02 01 “Технология молока и молочных продуктов”
Проверил: Выполнил:
Писарев П. Н. Студент группы ТЖМ – 112
Зайцева О.Ю.
«____» __________ 2013 г. «____» __________ 2013 г.
Могилев 2013
Введение
Цель работы: синтезировать изоамиловый эфир уксусной кислоты и провести расчет исходя из 33 см3 изоамилового спирта.
Особенности синтеза: основой заданного синтеза является реакция этерификации. Катализаторами являются минеральные кислоты.

Данная реакция обратима. Обратный процесс - расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта - называют гидролизом сложного эфира. Так как в ходе синтеза при взаимодействии образованной воды с полученным сложным эфиром идет реакция гидролиза эфира обратно в спирт и карбоновую кислоту, надо либо взять в избытке один из реагентов (руководствуются стоимостью реагентов), что увеличит выход конечного продукта синтеза; либо в ходе синтеза удалять один из продуктов (у низко кипящих эфиров удаляют эфир, а у высоко кипящих - воду). В определенных случаях достигают выхода продукта равного 95-97%. Добавление катализатора (серная кислота, бензол, толуол, хлороформ) способствует удалению воды из продуктов реакции. А добавление минеральных кислот, например H2SO4, еще и ускоряет реакцию образования эфира, а если добавить кислоту в количестве примерно 5-8% от объема спирта, то это увеличит конечный выход продукта до 90%. Но данный синтез возможен только с первичными спиртами, со вторичными и третичными спиртами значительно уменьшается выход продукта реакции. Данный синтез применяется в парфюмерной промышленности при синтезе душистых веществ.
1. Общие методы получения органических соединений данного класса
Ацилированием называют реакции замещения водорода спиртовой группы на остаток карбоновой кислоты. В результате ацилирования спиртов получают сложные эфиры. Ацилирование можно проводить различными методами; наиболее часто применяют следующее:
1.1 Непосредственное нагревание спирта с органической кислотой:
1.1.2 . Реакция обратима и не доходит до конца, если не принять меры к связыванию или удалению образующейся при реакции воды. Ацилирование спиртов может быть значительно облегчено прибавлением концентрированной серной кислоты или введением безводного хлористого водорода, которые не только связывают выделяющуюся при реакции воду, но также каталитически ускоряют процесс. Однако многие органические вещества претерпевают глубокие изменения в присутствии концентрированных минеральных кислот, и поэтому данный способ имеет лишь ограниченное применение.
1.2. Нагревание спирта с ангидридом кислоты:
Образования воды в этом случае не происходит и реакция идет в отсутствие водуотнимающих средств, вроде серной кислоты. Поэтому данный способ является более общеприменимым.
1. 3. Действие на спирт хлорангидрида кислоты:
Вследствие большой реакционной способности хлорангидридов реакция протекает весьма энергично; она широко применяется как в лабораторной практике, так и в технике. Прибавляя щелочь, можно связать выделяющуюся соляную кислоту и тем самым избежать, если это необходимо, нежелательного воздействия минеральной кислоты.
Наибольшее значение в препаративной практике получила реакция замещения гидроксильной группы карбоновой кислоты на алкоксигруппу – реакция этерификации. Реакция этерификации, являющаяся по сути реакцией ацилирования, используется в качестве основного способа получения сложных эфиров:
Механизм реакции можно рассмотреть на схеме:
С помощью метода меченых атомов было показано, что при проведении реакции этерификации действительно происходит замещение группы ОН на алкоксигруппу, а не замещение атома водорода на алкильную группу спирта. Так, при взаимодействии бензойной кислоты с меченым метиловым спиртом весь меченый кислород был обнаружен в образовавшемся метилбензоате, а не в воде:
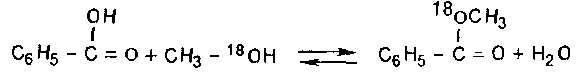
Такое течение реакции подтверждает и тот факт, что при проведении этерификации с участием оптически активного спирта активность продукта реакции сохраняется. Это может наблюдаться только в том случае, если в ходе реакции не затрагивается связь атома кислорода группы ОН спирта с асимметрическим атомом углерода.
Наиболее медленная стадия всего процесса — бимолекулярное взаимодействие протонированной кислоты с молекулой спирта, поэтому скорость реакции в первую очередь определяется значением δ+ на атакуемом атоме углерода и размерами R и R'.
Данная реакция обратима. Обратный процесс - расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта - называют гидролизом сложного эфира. Так как в ходе синтеза при взаимодействии образованной воды с полученным сложным эфиром идет реакция гидролиза эфира обратно в спирт и карбоновую кислоту, для смещения равновесия надо:
1) Равновесие можно сдвинуть вправо, используя 5-10-кратный избыток более дешевого исходного вещества (им обычно бывает спирт) ;
2) В ходе синтеза удалять один из продуктов (у низко кипящих эфиров удаляют эфир, а у высоко кипящих - воду). В определенных случаях достигают выхода продукта равного 95-97%.
3) Добавление катализатора (серная кислота, бензол, толуол, хлороформ) способствует удалению воды из продуктов реакции.
Вследствие малой активности карбонильных групп в карбоновых кислотах они, как правило, медленно реагируют со спиртами. Этерификацию можно существенно ускорить, добавляя сильные кислоты (серную кислоту, безводный хлороводород, сульфоновые кислоты, кислые ионообменные смолы).
Скорость этерификации карбоновой кислоты, как и следовало ожидать, возрастает вместе с ростом положительного заряда на карбонильном углероде, т.е. с ростом кислотности. Так, муравьиная, щавелевая, пировиноградная кислоты реагируют достаточно быстро и без добавления катализатора. Сильно влияют на этерификацию стерические факторы. С ростом объема алкильных остатков, связанных с карбоксильной группой, а также спиртовым гидроксилом, скорость этерификации падает. Поэтому разветвление у углеродного атома, а также замещенные ароматические
кислоты вступают в реакцию медленно и с плохими выходами. В ряду от первичных к третичным спиртам реакция затрудняется еще и тем, что в условиях реакции (сильнокислая среда) параллельно возрастает и тенденция к превращению спиртов в простые эфиры и олефины. Эфиры третичных спиртов получаются прямой этерификацией лишь с очень малыми выходами. Равновесие реакции этерификации не очень благоприятно для получения сложных эфиров.
Многие известные душистые вещества относятся к классу сложных эфиров. Последние широко распространены в природе и дают самые разнообразные оттенки запахов, от запаха тропических орхидей до характерного аромата хорошо знакомых нам фруктов. Эти соединения мы можем синтезировать. Сложные эфиры образуются при взаимодействии спиртов с карболовыми кислотами. При этом отщепляется вода
R-ОН
+ НООС- R1
![]() R-ООС-
R1
+ Н2О
R-ООС-
R1
+ Н2О
спирт + кислота
![]() сложный
эфир + вода
сложный
эфир + вода
Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлен летучими эфирами, например этиловым и изоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот. Имеющиеся в продаже эссенции, имитирующие эти запахи, содержат подобные эфиры.
Некоторые из сложных эфиров готовятся искусственно и под названием «фруктовых эссенций» широко применяются в кондитерском деле, в производстве прохладительных напитков, в парфюмерии и во многих других отраслях.
