
- •Департамент кадров и учебных заведений
- •Методические указания
- •Подписано в печать . Формат 60х90 1/16.
- •Определение эквивалента и эквивалентной массы металла по водороду
- •Определение тепловых эффектов химических реакций
- •Скорость химических реакций. Химическое равновесие
- •Растворы. Определение концентрации раствора.
- •Описание прибора:
- •Ход работы:
- •Форма записи:
- •Форма записи:
- •Формулы для расчета.
- •Электролитическая диссоциация. Реакции ионного обмена
- •Водородный показатель. Гидролиз солей
- •2. Гидролиз солей
- •Окислительно-восстановительные реакции
- •Классификация овр:
- •Гальванические элементы
- •Описание прибора
- •Электролиз
- •Химические свойства металлов
- •Коррозия металлов и борьба с ней
- •Определение временной и общей жесткости воды
- •Реактивы, посуда, оборудование
Гальванические элементы
Цель работы: опытным путем исследовать активность металлов и изучить анодный и катодный процессы, протекающие в гальваническом элементе.
Теоретическая часть.
Количественной характеристикой активности (способности отдавать электроны) являются значения потенциала ионизации и стандартного электродного потенциала. Электродный потенциал-это скачок потенциала, возникающий на границе металл/раствор электролита.
Стандартный электродный потенциал - это не абсолютное значение потенциала, а значение его относительно потенциала нормального водородного электрода, условно принятого за нуль, если концентрации всех участвующих веществ равны 1 моль/л.
Если расположить металлы в ряд в порядке возрастания их стандартных потенциалов, то получим ряд напряжений металлов (см. табл.8.1)
Таблица 8.1. Стандартные потенциалы металлов. Ряд напряжений.
-
Электрод
Потенциал, В
Электрод
Потенциал, В
Li/Li+
-3,045
Co/Co2+
-0,277
К/К+
-2,924
Ni/Ni2+
-0,250
Са/Са2+
-2,866
Sn/Sn2+
-0,136
Na/Na+
-2,714
Pb/Pb2+
-0,126
Mg/Mg2+
-2,363
Fe/Fe3+
-0,037
Al/Al3+
-1,663
H2/2H+
0
Ti/Ti2+
-1,630
Bi/Bi3+
0,215
Mn/Mn2+
-1,179
Cu/Cu2+
. 0,337
Zn/Zn2+
-0,763
Ag/Ag+
0,799
Cr/Cr2+
-0,744
Hg/Hg2+
0,850
Fe/Fe2+
-0,440
Pt/Pt2+
1,188
Cd/Cd2+
-0,403
Au/Au3+
1,498
Ряд напряжений выражает следующие закономерности:
1. Металлы, расположенные до магния, вытесняют водород из воды.
2. Металлы, стоящие в ряду напряжений до водорода, вытесняют водород из: растворов кислот (соляной, разбавленной серной и др., кроме азотной).
3. Каждый металл вытесняет расположенные после него металлы из растворов их солей (это условие выполняется для металлов, расположенных после магния).
Если концентрации электролитов не равны 1 моль/л, то электродный потенциал рассчитывается по уравнению Нернста:
![]() ,
,
где Е°- стандартный электродный потенциал,
n - заряд иона металла;
![]() -
молярная концентрация ионов металла
в растворе, моль/л или г-ион/л.
-
молярная концентрация ионов металла
в растворе, моль/л или г-ион/л.
Описание прибора
Гальваническими элементами называются устройства, в которых химическая энергия окислительно-восстановительной реакции превращается в электрическую энергию за счет различия величин электродных потенциалов двух электродных реакций.
Наиболее простой цинково-медный гальванический элемент был создан Даниэлем и Якоби. Схема его представлена на рисунке.
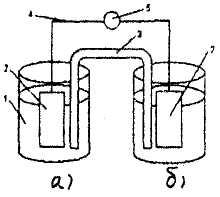
Рис.8.1. Схема гальванического элемента Даниэля - Якоби
1 -стаканы с растворами: а) сульфата пинка; б) сульфата меди
2 - цинковый и медный электроды
3 - электролитический ключ
4 - токопроводящая проволока
5 – гальванометр
Элемент устроен и работает следующим образом: в два сосуда с растворами (один – ZnSO4, а другой- CuSO4) опущены цинковая и медная проволоки (электроды) соответственно, которые соединены медной проволокой.
Величины стандартных электродных потенциалов цинка и меди соответственно равны Zn/Zn 2+ = - 0,76 В, Cu/Cu 2+ = +0,34 В и указывают, что на поверхности цинка, как более активного металла, больше электронов, чем на меди. При погружении в сосуды электролитического ключа (U - образной трубки, соединяющей сосуды между собой), наполненного электролитом, электроны с цинкового электрода будут перемешаться к медной пластине, при этом замкнется внешняя электрическая цепь.
Цинковый электрод начнет окисляться, посылая ионы Zn2+ в раствор:
Zn-2ē= Zn2+
Прибывшие на медный электрод электроны будут восстанавливать ионы меди, находящиеся в растворе: Сu2+ + 2ē = Сu°, атомы меди осаждаются на электроде. Медный электрод является катодом, цинковый - анодом.
Ионы
![]() ,
оставшиеся после восстановления ионов
меди, будут перемещаться по электролитическому
ключу в сосуд с сульфатом цинка в
эквивалентном количестве с образующимися
ионами цинка и замкнут электрическую
цепь.
,
оставшиеся после восстановления ионов
меди, будут перемещаться по электролитическому
ключу в сосуд с сульфатом цинка в
эквивалентном количестве с образующимися
ионами цинка и замкнут электрическую
цепь.
Суммарный процесс, протекающий на электродах, можно изобразить общим уравнением:
Zn0 + Cu2+ = Zn2+ + Cu0
Гальванический элемент будет работать до тех пор, пока не сравняются потенциалы медного и цинкового электродов. Работа элемента Даниэля - Якоби опишется схемой:
(-) Zn/ZnSO4//CuSO/Cu(+)
Для определения электродвижущей силы (ЭДС) гальванического элемента надо из потенциала катода вычесть потенциал анода. Величина ЭДС медно-цинкового гальванического элемента для стандартных условий составит:
![]() 0,34 - (-0,76) = 1,1 (В)
0,34 - (-0,76) = 1,1 (В)
Практическая часть.
Опыт №1. Активность металлов в растворах электролитов.
В три пробирки внесите растворы указанных солей. Опустите во все пробирки, хорошо зачищенные данные металлы. Составьте электронные уравнения протекающих реакций. Сделайте вывод о течении их с точки зрения электродных потенциалов металлов или о невозможности протекания других реакций.
Задания:
Соли Металл
1. Pb(NO3)2, CuCl2, ZnSO4 железо
2. CuSO4, BaCl2, FeSO4 цинк
3. Pb(NO3)2, CuCl2, MgCl2 алюминий
4. Hg(NO3)2, NaCl, CuSO4 олово
5. Hg(NO3)2, FeSO4, ZnSO4 медь
6. CuSO4, K2CrO4, Na2CO3 магний
7. Hg(NO3)2, NaCl, CuSO4 свинец
8. CuSO4, K2CrO4, Na2CO3 цинк
Опыт №2. Работа гальванического элемента Даниэля-Якоби.
Приготовьте раствор сульфата цинка нужной концентрации путем разбавления имеющегося раствора ZnSO4 концентрации 2н водой в мерном цилиндре (например, для приготовления раствора 0,1н надо разбавить в 2:0,1= 20 раз. Это можно сделать в два этапа: 1) разбавить в два раза, налив воды и раствора сульфата цинка поровну;
2) полученный раствор разбавить в 10 раз, для этого налить в мерный цилиндр 1 мл раствора и долить воды до 10 мл.
Соберите гальванический элемент по схеме, изображенной на рисунке 8.1. Дня этого налейте в один стакан, чуть-чуть не доходя до края, раствор сульфата цинка указанной концентрации, а в другой - столько же раствора сульфата меди указанной концентрации.
Заполните электролитический ключ - изогнутую стеклянную трубочку - раствором сульфата калия так, чтобы в трубочке не было воздушных пузырей, которые разомкнут электрическую цепь. Соедините оба стакана заполненным электролитическим ключом следующим образом: плотно закрыв пальцем один конец трубочки, другой опустите в стакан с раствором соли, быстро опустите второй конец в другой стакан. Если электролит выльется из трубочки в процессе погружения, то эту операцию необходимо повторить.
В раствор сульфата цинка опустите хорошо зачищенный цинковый электрод, в сульфат меди - медный электрод. Наблюдайте отклонение стрелки вольтметра. Напишите уравнения анодного и катодного процессов. Рассчитайте электродные потенциалы с учетом указанных концентраций по уравнению Нернста, ЭДС гальванического элемента. Сравните его значение с показанием вольтметра.
Задания:
1. Zn/ZnSO4 (0,2 н)//CuSO4(2h)/Cu
2. Zn/ZnSO4, (0,125 h)//CuSO4 (2h)/Cu
3. Zn/ZnSO4 (0,4 h)//CuSO4(2h)/Cu
4. Zn/ZnSO4 (0,5н)/CuSO4(2н)/Cu
5. Zn/ZnSO4 (0,025н)//CuSO4(2н)/Cu
6. Zn/ZnSO4(0,04н)//CuSO4(2н)/Cu
7. Zn/ZnSO4 (0,02н)//CuSO4(2н)/Cu
8. Zn/ZnSO4 (0,2н)//CuSO4(1н)/Cu
Опыт №3. Работа концентрационного гальванического элемента.
В качестве электродов используется один и тот же металл, опушенный в раствор соответствующей соли.
Задания:
Fe/FeSO4(2M)//FeSO4(0,1н)/Fe
Al/Al2(SO4)3(0,3M)//Al2(SO4)3(0,03н)/Аl
Co/CoSO4(4н)/Со//СоSO4(0,02M)
Ag/AgNO3(2н)//AgNO3(0,5M)/Ag
Cd/CdSO4(0,8M)//CdSO4(0,04н)/Cd
Mn/MnSO4(0,5н)//MnSO4(0,5M)/Mn
Bi/Bi(NO3)3(3н)//Bi(NO3)3(0,006M)/Bi
Mg/MgSO4(0,01M)//MgSO4(0,0002н)/Mg
Формулы для расчетов:
Пересчитайте нормальную концентрацию Сн в молярную концентрацию СМ:
![]() , отсюда
, отсюда
![]()
Эквивалентная масса ионов металла равна
![]()
![]() ,
,
где ![]() – молярная масса ионов металла,
– молярная масса ионов металла,
В – валентность металла.
Подставив Э в
формулу для СМ,
получим:
![]()
Вычислите электродный потенциал по уравнению Нернста.
Вычислите ЭДС как разность потенциалов катода и анода.
Лабораторная paбoтa №9
