
- •Оглавление
- •Глава 1
- •§ 1.1. Естественно-научная и гуманитарная культуры
- •§ 1.2. Классификация наук и отраслей естествознания
- •§ 1.3. Естествознание и религия
- •§ 1.4. Естествознание и философия
- •§ 1.5. Естествознание и математика
- •Глава 2
- •§ 2.1. Сущность научного знания
- •§ 2.2. Средства и методы науки
- •§ 2.3. Структура и уровни научного знания
- •§ 2.4. Этические проблемы в науке
- •Глава 3
- •§ 3.1. История естествознания и модели развития науки
- •§ 3.2. Традиции и новации в истории естествознания
- •§ 3.3. Этапы становления современного естествознания
- •§ 3.4. История отраслей естествознания
- •Глава 4
- •§ 4.1. Системный подход
- •§ 4.2. Модели и моделирование систем
- •§ 4.3. Системные исследования
- •Глава 5
- •§ 5.1. Пространство и время в естествознании
- •§ 5.2. Свойства пространства и времени
- •§ 5.3. Методы оценки пространства
- •§ 5.4. Методы оценки времени
- •Глава 6
- •§ 6.1. Иерархичность миров и границы нашего познания
- •§ 6.2. Концепции макромира и классическая механика
- •§ 6.3. Концепции мегамира и теория относительности
- •§ 6.4. Концепции микромира и квантовая механика
- •§ 6.5. Концепции возникновения и развития Вселенной
- •Глава 7
- •§7.1. Химические явления и их сущность
- •§ 7.2. Химический состав вещества
- •§ 7.3. Химическая структура вещества
- •§ 7.4. Химические процессы
- •§ 7.5. Химическая эволюция
- •Глава 8
- •§ 8.1. Форма и строение Земли
- •§ 8.2. Вещественный состав и строение земной коры
- •§ 8.3. Гидросфера и атмосфера Земли
- •§ 8.4. Геодинамические процессы
- •§ 8.5. Возникновение и геологическая история Земли
- •Глава 9
- •§ 9.1. Сущность и уровни организации жизни
- •§ 9.2. Концепции возникновения жизни
- •§ 9.3. Эволюционное учение в биологии
- •§ 9.4. Развитие жизни на Земле
- •§ 9.5. Человек: феномен, происхождение, биоэтика
- •Глава 10
- •§ 10.1. Основные свойства географической оболочки
- •§ 10.2. Функционирование географической оболочки
- •§ 10.3. История развития географической оболочки
- •§ 10.4. Географическая среда и глобальные проблемы человечества
- •Глава 11
- •§ 11.1. Глобальный эволюционизм
- •§ 11.2. Самоорганизация как элементарный процесс эволюции
- •§ 11.3. Закономерности самоорганизации и эволюционного процесса
§ 7.4. Химические процессы
Сущность химического процесса
Учение о химическом процессе характеризуется взаимодействием физики, химии и биологии и базируется на идеях химической термодинамики и кинетики, которые обычно рассматриваются в физической химии.
Химический процесс всегда был в центре внимания химиков. Однако понимание его сущности стало возможным лишь в конце XIX в., а современное представление о том, что такое химический процесс, сложилось в 1950-х гг.
Условия среды на Земле таковы, что молекулы непрерывно разрушаются и снова образуются. Если бы температура Земли была значительно выше, например как температура поверхности Солнца, то многие молекулы никогда бы не образовались из-за слишком сильного теплового возбуждения (атомы не могли бы оставаться друг возле друга), а если бы температура Земли была гораздо ниже, молекулы, соединяясь, образовали бы твердые тела и кристаллы и никакие изменения не происходили. Температура на Земле такова, что энергии достаточно для разрушения некоторых молекул, однако количество энергии не слишком велико, благодаря чему большинство соединений может существовать в течение какого-то времени. Создание и разрушение молекул сообщают постоянные изменения окружающей среде и создают тем самым возможность жизни.
Одно из важнейших следствий образования молекул состоит в высвобождении энергии [2]. Этот процесс особенно нагляден при сжигании угля или других веществ. Горение любого типа связано с образованием новых молекул и, следовательно, с выделением тепловой энергии. Рассмотрим подробнее, как и почему высвобождается энергия при соединении атомов в молекулы. Понятно, что для разрыва химической связи требуется некоторое количество энергии и такое же ее количество высвобождается при образовании связи. Таким образом, нужно затратить энергию, чтобы разделить молекулу на атомы, и энергия выделяется, когда атомы образуют молекулу. Эта энергия проявляется в различных формах, например в виде колебаний. Когда атомы соединяются, образующаяся молекула начинает колебаться в результате сильного столкновения атомов. Вообще, когда атомы образуют молекулу, энергия высвобождается и обычно проявляется в форме движения, что эквивалентно теплоте. В некоторых особых случаях энергия связи не превращается в теплоту: химические реакции присоединения происходят таким образом, что энергия, выигранная при образовании молекул, передается молекулам другого рода, т.е. энергия образования молекулы запасается в другой молекуле, а не растрачивается в виде теплоты. Этот случай важен для поддержания жизни.
Обратимся к такому хорошо известному химическому процессу, как процесс горения угля. Углерод угля и кислород воздуха образуют углекислый газ - диоксид углерода. Кусок угля - это совокупность атомов углерода, расположенных в правильном порядке, т.е. кристалл углерода. Кислород воздуха состоит из молекул кислорода. Поэтому химическая реакция горения угля имеет вид
С + О2=СО2.
Эта реакция происходит в два этапа: сначала разрывается связь в молекуле О2, а затем два атома кислорода присоединяются к углероду. Первый этап требует затрат энергии. При обычных температурах тепловой энергии недостаточно для расщепления молекулы кислорода на два атома, как в тех случаях, когда уголь соприкасается с воздухом без горения. Но если подвести теплоту от зажженной спички или горящей щепки, то реакция начнется. На втором ее этапе при образовании СО2 выделяется больше энергии, чем требуется для расщепления О2 (рис. 7.5, а). Поэтому энергия, необходимая для дальнейшего расщепления О2, поставляется самим процессом горения. Таким образом, при горении угля большая часть энергии выделяется в виде теплоты, а часть энергии, высвобождаемой на втором этапе, идет на инициирование дальнейших реакций. Полезная теплота равна избытку энергии, выделяющейся на втором этапе, над энергией, потребной для первого этапа.
Начавшись, образование диоксида углерода продолжается до тех пор, пока не израсходуется весь углерод. При этом выделяется большое количество теплоты. Нагревание столь сильно, что атомы и молекулы начинают испускать свет. Пламя, которое мы видим при горении угля, состоит из молекул СO2 и атомов углерода, выброшенных в результате сильного нагрева и испускающих излучение. Таким образом, пламя не вид вещества (флогистон), как некогда полагали. Это накаленная материя, полученная в химической реакции, в которой выделяется очень много энергии.
Горение угля - простейшая форма выделения химической энергии. Аналогичный процесс происходит при горении метана и других углеводородов. Здесь требуется начальная теплота, чтобы расщепить и молекулы О2, и молекулы углеводорода. После этого углерод соединяется с кислородом, образуя диоксид углерода, а водород соединяется с кислородом, образуя воду. Химическая реакция горения метана СН4 показана на рис. 7.5 б.
Так как в молекулах СН4 и О2 связи существенно слабее, чем в молекулах СО2 и Н2О, чистый выигрыш энергии в данной реакции очень велик. Поэтому метан и другие углеводороды дают сильное пламя и много теплоты. Однако в отличие от горения угля в пламени углеводородов вместе с раскаленным СО2 содержится водяной пар. Если подержать холодное стекло в пламени свечи или горящего дерева, то на стекле образуется конденсированный водяной пар, который не получается в пламени чистого угля.
Таким же образом любая молекула, состоящая из углерода, водорода и кислорода, может гореть, т.е. превращаться в углекислый газ и водяной пар, соединяясь с кислородом воздуха. Но для горения молекул спирта или сахара нужно меньшее количество кислорода, поскольку они сами содержат О2.
Химические реакции, производящие энергию, всегда начинаются с превращения молекул со слабыми связями в молекулы с прочными связями; при этом высвобождается разница в энергиях сильной и слабой связи. Молекулы СО2 и воды имеют прочные связи; то же можно сказать о большинстве молекул, в которых атомы связаны с кислородом. Молекулы, содержащие углерод и водород, связаны слабо, они легко разрушаются и рекомбинируют, могут образовывать длинные цепи и способны объединяться в сложные структуры. Если их слабые связи превращаются в сильные связи с кислородом в результате какого-либо сложного процесса, то выделяется энергия. Благодаря этим свойствам они играют важную роль в живой материи.
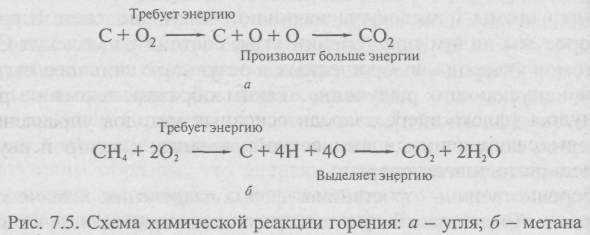
Принципы управления химическим процессом
Основная проблема в учении о химических процессах связана с тем, что многие химические реакции были и остаются трудноуправляемыми. Одни из них пока не удается осуществить, хотя в принципе они выполнимы. Другие сложно остановить, например реакцию горения и взрывы. Трудности управления третьими обусловлены тем, что в их процессе самопроизвольно создается множество непредвиденных ответвлений с образованием побочных продуктов [15, 16].
Суть проблемы заключается в следующем. Каждая химическая реакция обратима и представляет собой перераспределение химических связей. Обратимость служит основанием равновесия между прямой и обратной реакциями. Однако на практике равновесие смещается в ту или иную сторону в зависимости от природы реагентов и условий процесса. Реакции, в которых равновесие смещено «вправо» - в сторону образования целевых продуктов, обычно не требуют особых средств управления. Таковы реакции кислотно-основного взаимодействия, или нейтрализации, а также реакции, сопровождающиеся удалением готовых продуктов в виде газов или осадков.
Однако немало реакций происходит со смещением равновесия «влево». Для их осуществления требуется особое термодинамическое управление. Такова, в частности, реакция синтеза аммиака:
N2 + 3Н2 ↔ NH3.
Эта реакция очень проста с точки зрения состава и структуры исходных веществ. Но на протяжении XIX в. попытки ее осуществления приводили к неудачам. В настоящее время решение проблемы управления химическими процессами продвинулось далеко вперед. Среди основных методов управления ими выделяют термодинамические и кинетические (в первую очередь каталитические).
Основы теории термодинамических методов управления химическими процессами были заложены в конце XIX в. в рамках химической термодинамики, которая изучает химические превращения на основе представления о термодинамическом равновесии в макроскопических системах. Химическая термодинамика включает учения о химическом равновесии, растворах, фазовых переходах и процессах на границе раздела фаз. В их основу положены идеи нидерландского ученого Я.Х. Вант-Гоффа, установившего зависимость направления химической реакции от изменения температуры и теплового эффекта реакции, а также принцип подвижного равновесия французского исследователя А.Л. Ле Шателье, согласно которому каждая реакция обратима, но равновесие смещается в зависимости от природы реагентов и условий процесса. Таким образом, основными рычагами управления реакцией служат температура, давление и концентрации реагирующих веществ.
В настоящее время термодинамические соотношения широко применяют для определения максимально возможного (при данных температуре, давлении и т.п.) выхода продуктов химических реакций и прочих параметров технологических процессов в химической, металлургической и других отраслях промышленности. Использование понятий и методов термодинамики неравновесных процессов позволяет оценивать потоки теплоты и вещества для открытых систем с учетом скоростей химических превращений, но влиять только на направленность.
Кинетические (в первую очередь каталитические) методы дают возможность влиять и на скорость химических процессов. Эти методы активно развиваются в рамках химической кинетики - учения о скоростях и механизмах химических реакций, надежной основы создания новых и совершенствования существующих процессов химической технологии: горения, гетерогенного катализа, электрохимических процессов и др. Методы химической кинетики используются в биологии и других областях естествознания. С их помощью удается добиться изменения хода процессов при изменении структурно-кинетических факторов: строения исходных реагентов, их концентрации, наличия в реакторе катализаторов (веществ, ускоряющих химические реакции), ингибиторов (веществ, замедляющих реакции) и других добавок, способов смешения реагентов, материала и конструкции реакторов и т.д.
К наиболее важным кинетическим методам относится ускорение химической реакции в присутствии катализаторов — катализ (от греч. katalysis — разрушение). Катализаторы (синтетические алюмосиликаты, металлы платиновой группы, серебро, никель и др.) взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав продуктов. Катализ был открыт в 1812 г. российским ученым К.Г.С. Кирхгофом, который получил сахар с помощью катализатора (серной кислоты) из крахмала. Различают гомогенный катализ, когда исходные реагенты и катализатор находятся в одной фазе (газовой или жидкой), и гетерогенный, когда газообразные или жидкие реагенты взаимодействуют на поверхности твердого катализатора. Катализ обусловливает высокие скорости реакций при небольших температурах. Каталитические реакции являются основой многих химико-технологических процессов (например, производства серной кислоты, некоторых полимеров, аммиака). Большинство процессов, происходящих в живых организмах, также являются каталитическими (или ферментативными, так как биологические катализаторы называются ферментами).
На современном уровне знания суть катализа может быть охарактеризована следующим образом. Во-первых, катализ представляет собой способ проведения химических реакций, особенность которого состоит в активизации молекул и ослаблении химических связей реагента при их контакте с катализатором. Во-вторых, в общем случае любую каталитическую реакцию можно представить проходящей через промежуточный комплекс, в котором происходит перераспределение ослабленных (неполновалентных) химических связей. В-третьих, в большинстве случаев в качестве катализаторов выступают соединения, молекулы которых содержат широкий набор энергетических неоднородных связей или даже свободные атомы на поверхности. В-четвертых, следствием взаимодействия молекул реагента с катализатором является не только ослабление исходных связей, а еще четыре эффекта: 1) химическая ориентация в заданном направлении, при котором катализатор выбирает из нескольких возможных направлений какое-либо одно; 2) матричная ориентация реакций, проявляющаяся в том, что изменение структуры молекул реагента определяется особенностями геометрического строения катализатора или особенностями структуры каталитического комплекса; 3) увеличение количества встреч реагирующих молекул при переводе реакции из объема на поверхность катализатора; 4) захват твердым телом катализатора некоторой части энергии реакции, т.е. превращение катализатора в «энергетическую ловушку» для энергетической подпитки новых актов реакции.
