
Osnovnye_klassy_neorganicheskikh_soedineny
.pdfродных соединений в воде. Таким способом можно получить кислоты HCl, HI, HBr, HF, H2S. Например:
H2 + I2 = 2HI, раствор в воде — иодоводородная кислота; H2 + Cl2 = 2HCl, раствор в воде — хлороводородная кислота.
2.Бескислородные кислоты также можно получить взаимодействием солей бескислородных кислот с более сильными кислотами (см. табл. 3.1). Например:
FeS + 2HCl = FeCl2 + H2S , раствор H2S в воде — сероводо-
родная кислота.
3.Кислородсодержащие кислоты получают взаимодействием кислотных оксидов (кроме SiO2) c водой:
SO3 + H2O = H2SO4,
P2O5 + 3H2O = 2H3PO4.
4. Если кислотные оксиды нерастворимы в воде, то соответствующие им кислоты получают косвенным путем: действием другой кислоты (чаще всего серной) на соответствующую соль. Например:
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3 .
4. АМФОТЕРНЫЕ ГИДРОКСИДЫ. ХИМИЧЕСКИЕ СВОЙСТВА И СПОСОБЫ ПОЛУЧЕНИЯ
Сточки зрениятеорииэлектролитической диссоциацииамфотерные гидроксиды — это слабые электролиты, способные диссоциировать как по типу оснований(в кислой среде), так и по типу кислот (в щелочной среде). К амфотерным гидроксидам относятся Al(OH)3, Zn(OH)2, Sn(OH)2, Be(OH)2, Pb(OH)2, Cr(OH)3 и др. Диссоциацию амфотерного гидроксида по обоим типам (без учета ступенчатого характера диссоциации) можно представить следующей схемой:
+H+ |
+OH– |
Men+ + nOH– Me(OH)n HnMeOn nH+ + MeOnn–,
диссоциация |
диссоциация |
по типу основания |
по типу кислоты |
+H+ |
+OH– |
Zn2+ + 2OH– Zn(OH)2 H2ZnO2 2H+ + ZnO22–.
В насыщенном водном растворе осадок амфотерного гидроксида и ионы Men+, OH–, H+ и MeOnn– находятся в состоянии равновесия, поэтому амфотерные гидроксиды взаимодействуют
21
и с кислотами, и с основаниями. При добавлении кислоты равновесиесмещается всторону диссоциации по типуоснования, при добавлении основания равновесие смещается в сторону диссоциации по типу кислоты. Формулы амфотерных гидроксидов можно записывать как в форме оснований, так и в форме кислот. Соответственно каждый амфотерный гидроксид можно рассматривать как основание и как кислоту. Амфотерные гидроксиды, молекулы которых содержат три и более гидроксидных группы — OH–, образуют две кислотные формы: ортоформу и метаформу. Переход ортоформы в метаформу происходит в результате отщепления молекулы воды:
–H2O
Me(OH)3 H3MeO3 HMeO2
–H2O
Al(OH)3 H3AlO3 HAlO2
ортоалюминиевая метаалюминиевая кислота кислота
Поагрегатномусостояниюамфотерные гидроксидыпредставляютсобойтвердыевещества.Этисоединенияплохорастворимы в воде и обладают характерным для каждого из них цветом,
например, Zn(OH)2 и Al(OH)3 — белого цвета, Cr(OH)3 —
зеленого, Fe(OH)3 — бурого и т.д.
Амфотерные гидроксиды проявляют свойства как кислот, так
иоснований.
1.Проявляя основные свойства, амфотерные гидроксиды взаимодействуют с кислотами, например:
Cr(OH)3 + 3HCl = CrCl3 + 3H2O; Sn(OH)2 + H2SO4 = SnSO4 + 2H2O.
2.Проявляя кислотные свойства, амфотерные гидроксиды взаимодействуют со щелочами:
а) сплавление твердых амфотерных гидроксидов с твердыми щелочами:
T
Sn(OH)2 + KOH = K2SnO2 + 2H2O,
(H2SnO2) |
станнит калия |
|
|
T |
+ 2H2O, |
Al(OH)3 + NaOH = NaAlO2 |
||
(H3AlO3) недостаток метаалюминат натрия
22
T
Al(OH)3 + 3NaOH = Na3AlO3 + 3H2O;
(H3AlO3) избыток ортоалюминат натрия
б) взаимодействие с водными растворами щелочей: Zn(OH)2 + 2NаOH = Na2[Zn(OH)4],
тетрагидроксоцинкат
натрия
Al(OH)3 + KOH = K[Al(OH)4],
недостаток тетрагидроксоалюминат калия
Al(OH)3 + 3KOH = K3[Al(OH)6].
избыток гексагидроксоалюминат калия
3. Как и нерастворимые основания, амфотерные гидроксиды разлагаются при нагревании на оксид и воду, например:
T
2Cr(OH)3 = Cr2O3 + 3H2O.
Амфотерные гидроксиды получают так же, как и слабые нерастворимые в воде основания, т.е. взаимодействием соли соответствующего металла со щелочью, но при этом используют строго эквивалентное ее количество, так как в избытке щелочи образующиеся осадки амфотерных гидроксидов растворяются.
Например: AlCl3 + 3NaOH = Al(OH)3 + 3NaCl; Cr2(SO4)3 + 6KOH = 2Cr(OH)3 + 3K2SO4.
5.СОЛИ
Ксолям относятся вещества, диссоциирующие в растворах с образованием положительно заряженных ионов, отличных от ионов водорода,и отрицательно заряженных ионов,отличныхот гидроксид-ионов. Соли можно рассматривать как продукты замещения атомов водорода в кислоте атомами металлов (или
группами атомов, например, группой атомов NH4) или как продуктызамещения гидроксидныхгрупп в молекуле основания кислотными остатками.
5.1.Классификация и номенклатура солей
По агрегатному состоянию соли представляют собой твердые вещества.
По растворимости в воде соли делятся на растворимые в воде, малорастворимые и нерастворимые. Растворимыми являются практически все соли щелочных металлов и соли аммония.
23

Хорошо растворимы все соли азотной кислоты — нитраты и уксусной кислоты — ацетаты. Среди солей серной кислоты нерастворимым является лишь сульфат бария BaSO4, малорастворимысульфатыкальцияCaSO4 исвинца(II)PbSO4.Хорошо растворимы также почти все хлориды, кроме нерастворимого хлорида серебра (I) AgCl и малорастворимого хлорида свинца (II) PbCl2. А вот большинство солей фосфорной кислоты — фосфатов, угольной кислоты — карбонатов и сероводородной кислоты — сульфидов относятся к нерастворимым в воде веществам.
В зависимости от состава различают соли: средние (или нормальные),кислые,основные,смешанные,двойные,комплексные.
Средние (или нормальные) соли можно рассматривать как продукты полного замещения атомов водорода в молекуле кислоты атомами металлов (или группой атомов NH4) либо как продукты полного замещения гидроксидных групп в молекуле основания кислотными остатками:
|
замещение |
замещение |
H2SO4 |
CuSO4 |
Cu(OH)2; |
кислота |
атомов водорода соль |
гидроксидных групп основание |
|
атомом меди |
кислотным остатком |
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O (реакция нейтрализации).
Названия средних (или нормальных солей) по международной номенклатуре образуются из названия кислотного остатка (см. табл. 3.2) и названия металла (или группы атомов NH4) (в род. падеже). Если в состав соли входит металл, имеющий переменную валентность, то она указывается в названии римскими цифрами (в скобках). Например: NaCl — хлорид натрия, Fe(NO3)3 — нитрат железа (III), FeSO4 — сульфат железа (II), K2SO3 —сульфиткалия,NH4Cl—хлоридаммония,(NH4)3PO4 — фосфат аммония.
Согласно русской номенклатуре названия солей образуются от названия кислоты с окончанием -кислый и названия металла (см. табл. 3.2). Например, Na2SO4 — сернокислый натрий. Если металл имеет переменную степень окисления, то для солей с высшей степенью окисления металла прибавляют слово окисное(ая), а для солей с низшей степенью окисления металла —
24

словозакисное(ая).Например:Fe2(SO4)3 —сернокислоежелезо окисное; FeSO4 — сернокислое железо закисное.
Названия средних солей бескислородных кислот составляют от названий неметалла с окончанием -истый и металла. Например: КСl — хлористый калий. Соли металлов с переменной степенью окисления различают по окончанию прилагательного.
3 |
2 |
Например: FeCl3 |
— хлорное железо; FeCl2 — хлористое |
железо.
Почти все растворимые средние соли являются сильными электролитами, т.е. в водных растворах полностью диссоциируют наионы металлов (или ионыаммония) и кислотных остатков,
например: NaCl Na+ + Cl–; CuSO4 Cu2+ + SO42–,
(NH4)3PO4 3NH4+ + PO43–.
При составлении графических формул солей следует в графическихформулахсоответствующихкислотзамещатьатомыводорода атомами металла с учетом валентности металла или в графическихформулах основанийзамещатьгидроксидные группы на кислотные остатки.
Средняя cоль CaSO4:
H - O |
O |
O |
O |
S |
|
Са |
S |
H - O |
O |
O |
O |
Кислота |
|
Соль |
|
Кислые соли можно рассматривать как продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла (или группой атомов NH4), например:
Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O,
NaOH + H3PO4 = NaH2PO4 + H2O,
2NaOH + H3PO4 = Na2HPO4 + 2H2O.
По международной номенклатуре названия кислых солей образуются по тем же общим правилам, что и названия средних солей, но с добавлением к кислотному остатку приставки гидро-, указывающей на наличие незамещенных атомов водорода, число которых обозначают греческими числительными (ди, три, тетра и т.д.). Если в состав соли входит металл, имеющий переменную
25

валентность, то она указывается римскими цифрами в скобках. Например: NaHCO3 — гидрокарбонат натрия, K2HPO4 — гидрофосфат калия, KH2PO4 — дигидрофосфат калия, Ca(H2PO4)2 — дигидрофосфат кальция, FeHPO4 — гидрофосфат железа (II).
Согласно русской номенклатуре для кислых солей перед названием соли ставится слово кислый, а в случае солей, образованныхвзаимодействиемсмногоосновнымикислотами,указывается количество замещенных атомов водорода. Например: NaHCO3 — кислый углекислый натрий; NaH2PO4 — кислый фосфорнокислый однозамещенный натрий; Na2HPO4 — кислый фосфорнокислый двузамещенный натрий.
В водных растворах кислые соли диссоциируют на катионы металла и сложные анионы:
NaHCO3 Na+ + HCO.
При составлении графических формул кислых солей следует помнить, что замещение атомов водорода в молекулах многоосновных кислот атомами металла происходит лишь частично.
Кислая соль NaHCO3:
H - O |
Na - O |
С = О |
С = О |
H - O |
H - O |
Кислота Соль
Основныесолиможно рассматриватькакпродуктынеполного замещения гидроксидных групп в молекулах многокислотных оснований кислотными остатками. Основные соли, как и основания, содержат в своем составе гидроксидные группы, способные в процессе электролитической диссоциации отщепляться в виде гидроксид-ионов ОН–.
По международной номенклатуре названия основных солей складываются из слова гидроксо, обозначающего группу –ОН, прибавляемого к названию кислотного остатка, за которым следуетназвание металла(врод.падеже),и,принеобходимости, указывается его валентность римскими цифрами в скобках. Например: FeOH(NO3)2 — гидроксонитрат железа (II), Fe(OH)2NO3 — дигидроксонитрат железа (III). Достаточно широко распространена и другая номенклатура, предусматривающая присоединение словагидроксок названию металла, напри-
26

мер:FeOH(NO3)2 —нитратгидроксожелеза(III),Fe(OH)2NO3 —
нитрат дигидроксожелеза (III).
Согласно русской номенклатуре для основных солей перед названием соли ставится слово основное(ая, ой). Например, AlOHSO4 — основной сернокислый алюминий.
Вводныхрастворах основныесолидиссоциируют насложные катионы и анионы кислотных остатков:
CuOHNO3 CuOH+ + NO3–.
При составлении графическихформул основных солей следует учитывать заряды сложных катионов, которые входят в их
состав. |
|
Основная соль CuOHCl: |
|
O—H |
O–H |
Cu |
Cu |
O—H |
Cl |
Основание |
Соль |
Взависимостиотсоставаразличаютсолидвойные,смешанные
икомплексные.
Двойные соли являются продуктами совместной кристаллизации двух разных нормальных солей, образованных одной и той же кислотой, например, сульфата калия K2SO4 и сульфата алюминия Al2(SO4)3: K2SO4•Al2(SO4)3 (сульфат калия-алюми- ния).
Смешанные соли образованы одним металлом и двумя кислотами.Примерами смешанных солей являются:PbFCl —фторид- хлорид свинца (II), Ca(ClO)Cl — хлорид-гипохлорид кальция.
Смешанные и двойные соли в водных растворах необратимо диссоциируют на все входящие в их состав катионы и анионы:
PbFCl Pb2+ + F– + Cl–;
Ca(ClO)Cl Ca2+ + ClO– + Cl–.
Комплексные соединения, состоящие из катионов металла и комплексных анионов (например, K4[Fe(CN)6]) или из комплексных катионов и анионов кислотных остатков (например, [Cu(NH3)4]Cl2, являются комплексными солями.
5.2. Химические свойства и способы получения солей
Химические свойства солей обусловливаются их взаимодействием с металлами, щелочами, кислотами и друг с другом.
27
1.Растворимые вводе соли взаимодействуют сболее активными металлами, чем металл, входящий в их состав, т.е. в ряду стандартных электродных потенциалов каждый предыдущий металл вытесняет последующие из растворов их солей:
Fe + CuSO4 = FeSO4 + Cu;
Zn + Pb(NO3)2 = Zn(NO3)2 +Pb.
2.Растворы солей вступают в обменные реакции с растворами щелочей при условии, что одним из продуктов реакции является либо нерастворимое основание, либо нерастворимая соль:
2KOH + CuSO4 = Cu(OH)2 + K2SO4; Ba(OH)2 + Na2SO4 = BaSO4 + 2NaOH.
3.Соли взаимодействуют с кислотами:
а) при взаимодействии средней соли с избытком кислоты образуются новая средняя соль и новая кислота. Реакция возможна, если образующаяся соль выпадает в осадок или если образующаяся кислота является более слабой, чем вступающая в реакцию:
Pb(NO3)2 + 2HI = PbI2 + 2HNO3;
Pb(CH3COO)2 + 2HNO3 = Pb(NO3)2 + 2CH3COOH;
слабая кислота
б) взаимодействие нормальной соли, образованной многоосновной кислотой, с избытком этой кислоты приводит к образованию кислой соли:
Na2S + H2S = 2NaHS;
в) основная соль, содержащая одну гидроксогруппу, при взаимодействии с избытком кислоты, образующей эту соль, образует нормальную соль и воду:
CuOHNO3 + HNO3 = Cu(NO3)2 + H2O.
При наличии двух гидроксогрупп в молекуле основной соли и недостатке кислоты образуется новая основная соль, а при избытке — нормальная соль:
Cr(OH)2Cl + HCl = CrOHCl2 + H2O;
недостаток
Cr(OH)2Cl + 2HCl = СrCl3 + 2H2O;
избыток
г) кислые соли при взаимодействии с избытком кислоты, не образующей эту соль, образуют нормальную соль:
Mg(HCO3)2 + 2HCl = MgCl2 + 2H2O + CO2.
28
Таким образом, взаимопревращения трех типов солей можно представить следующей схемой:
+Н+ +Н+
Основная соль Нормальная соль Кислая соль
+ОН– +ОН–
4. Соли взаимодействуют между собой с образованием новых солей; при этом одна из образующихся солей должна быть нерастворимой, например:
AgNO3 + NH4Cl = AgCl + NH4NO3;
CuCl2 + Na2S = CuS + 2NaCl.
5. Многие соли разлагаются при нагревании. Продуктами разложения многих солей являются оксиды. Например:
T
СaCO3 =CaO + CO2;
T
CuSO4 =CuO + SO3.
Все важнейшие способыполучениясолейоснованы на тех химических реакциях, которые были рассмотрены выше при изучении свойств оксидов, оснований, кислот и солей.
1.Взаимодействие кислот и оснований (реакция нейтрализации):
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O.
2.Взаимодействие основных или амфотерных оксидов с кислотными:
BaO + CO2 = BaCO3;
Cr2O3 + 3SO3 = Cr2(SO4)3.
3. Взаимодействие основных или амфотерных оксидов с кислотами:
K2O + 2HCl = 2KCl + H2O;
ZnO + 2HNO3 = Zn(NO3)2 + H2O.
4. Взаимодействие оснований с кислотными оксидами:
Ca(OH)2 + N2O5 = Ca(NO3)2 + H2O. 5. Взаимодействие щелочей с солями:
2LiOH + SnCl2 = 2LiCl + Sn(OH)2 . 6. Взаимодействие солей с кислотами:
BaCl2 + H2SO4 = BaSO4 + 2HCl;
K2CO3 + 2HCl = 2KCl + CO2 + H2O. 7. Взаимодействие двух различных солей:
Na2CO3 + BaCl2 = BaCO3 + 2NaCl.
29
8. Взаимодействие солей с металлами: CuCl2 + Ni = NiCl2 + Cu.
9. Взаимодействие металлов с кислотами. При взаимодействии большинства кислот (кроме HNO3 и конц. H2SO4) с металлами, находящимися в ряду напряжений до водорода, наряду с солью образуется водород, например:
Zn + H2SO4 = ZnSO4 + H2 .
Азотная кислота и концентрированная серная кислота при взаимодействии с металлами также образуют соли, но вместо водорода образуются другие продукты.
10. Взаимодействие металлов с неметаллами. Этим способом могут быть получены соли некоторых бескислородных кислот:
Hg + S = HgS; 2Fe + 3Cl2 = 2FeCl3.
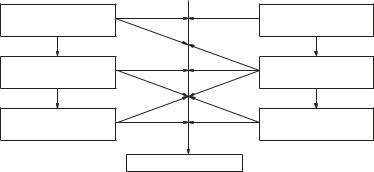
5.3. Генетическая связь между важнейшими классами неорганических веществ
Многочисленные способы получения солей из веществ, принадлежащих к разным классам, свидетельствуют о том, что между этими классами неорганических веществ существует тесная взаимосвязь.
Связь между классами неорганических соединений, которая основанана получении веществодногоклассаиз веществдругого класса, называется генетической.
Генетическая связь между важнейшими классами неорганических веществ может быть проиллюстрирована схемой, изображенной на рис. 2.
Металл |
Неметалл |
+О2 |
+О2 |
Основной оксид |
Кислотный оксид |
+Н2О |
+Н2О |
Основание |
Кислота |
Соль
Рис. 2. Генетическая связь между важнейшими классами неорганических веществ
30
