
osnov_klass_neorg_coedinenii
.pdf
54 Н624
СИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПУТЕЙ СООБЩЕНИЯ
Е.И. НИКИТИНА
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Методические указания к лабораторно-практическим занятиям и самостоятельной работе по химии
НОВОСИБИРСК 2010
УДК 546(076.5)
Н624
Никитина Е.И. Основные классы неорганических соеди-
нений: Метод. указ. к лабораторно-практическим занятиям и самостоятельной работе по химии. — Новосибирск: Изд-во СГУПСа, 2010. — 36 с.
В методических указаниях рассмотрены вопросы классификации и номенклатуры химических веществ. Представлены основные классы неорганических соединений, для каждого класса описаны основные способы получения и химические свойства веществ. Для закрепления изучаемого материала и приобретения практических навыков предлагаются контрольные вопросы, задания для самостоятельной работы и лабораторная работа.
Предназначены для студентов инженерно-технических специальностей дневного и заочного отделений.
Рассмотреныирекомендованыкизданиюназаседаниикафедры «Химия».
Ответственный редактор д-р хим. наук, проф. С.А. Кутолин
Р е ц е н з е н т канд. хим. наук, доц. кафедры «Химия» НГТУ
О.В. Андрюшкова
Никитина Е.И., 2010
Сибирский государственный университет путей сообщения, 2010
ВВЕДЕНИЕ
Число известных к настоящему времени веществ — более десяти миллионов (из них — несколько сот тысяч неорганических), поэтому очень важна классификация химических соединений. Под классификацией понимают объединение разнообразных и многочисленных соединений в определенные группы или классы, обладающие сходными свойствами. Классификация тесно связана с проблемой номенклатуры, т.е. системой названий этих веществ. Как классификация, так и номенклатура химических соединений складывались на протяжении столетий, поэтому они не всегда являются логичными и отражают исторический путь развития науки.
Номенклатуранеорганических веществ,состоящая изформул и названий, является важной информационной областью неорганической химии. В современной химии используется несколько видов номенклатуры: международная систематическая номенклатура ИЮПАК (IUPAC — Международный союз теоретическойиприкладнойхимии);номенклатура,разработаннаяАссоциацией научного образования (ASE); исторически сложившиеся тривиальная и рациональная номенклатуры.
Современнаяноменклатуравключаетвсебякак систематические названия, построенные по общим правилам, так и широко используемые традиционные названия, которые отшлифовывались в течение долгого времени.
Все вещества делятся на простые(элементарные) и сложные. Простые вещества состоят из одного элемента, в состав сложных
3
входит два или более элементов. Простые вещества, в свою очередь, разделяются на металлы и неметаллы.
Металлы отличаются характерным «металлическим» блеском, ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей теплопроводностью и электрической проводимостью. При комнатной температуре все металлы (кроме ртути) находятся в твердом состоянии.
Неметаллы не обладают характерным для металлов блеском, хрупки, очень плохо проводят теплоту и электричество. Некоторые из них при обычных условиях газообразны.
Сложные вещества делят на органические, неорганические и элементоорганические.
Неорганические вещества разделяются на классы либо по составу (двухэлементные, или бинарные и многоэлементные соединения;кислородсодержащие,азотсодержащиеит.п.),либо по химическим свойствам, т.е. по функциональным признакам (кислотно-основным, окислительно-восстановительным и т.д.), которые эти вещества осуществляют в химических реакциях.
Из бинарных соединений наиболее известны оксиды. Среди многоэлементных соединений важную группу составляют гидроксиды — вещества, содержащие гидроксогруппы ОН. Некоторые из них (основные гидроксиды) проявляют свойства оснований — NaOH, Ba(OH)2 и т.п.; другие (кислотные гидроксиды) проявляют свойства кислот — HNO3, H3PO4 и другие; амфотерные гидроксиды способны в зависимости от условий проявлять какосновные,такикислотныесвойства—Zn(OH)2,Al(OH)3 ит.п.
К важнейшим классам неорганических многоэлементных соединений, выделяемым по функциональным признакам, относятся кислоты,основанияисоли.Такимобразом,каждыйкласс объединяет вещества, сходные по составу и свойствам (рис. 1).
4
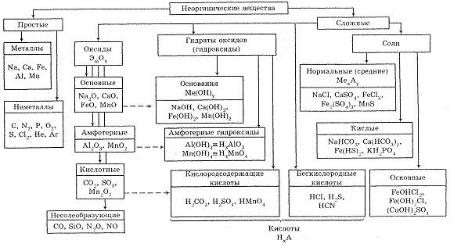
Рис. 1. Важнейшие классы неорганических веществ
1. ОКСИДЫ
Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления –2.
Общая формула оксидов: ЭmОn, где Э — элемент, m и n — количество атомов данного элемента и кислорода. В оксидах кислород присоединяется только к атомам других элементов
(Na—O—Na, Mg=O, O=C=O, О=Аl—О—Аl=О и др.).
За небольшим исключением (He, Ne и Ar), большинство известных химических элементов образуют соединения с кислородом, т.е. образуют оксиды, которые в обычных условиях бывают втвердом, реже —в жидком игазообразном состояниях.
1.1. Классификация и номенклатура оксидов
По химическим свойствам все оксиды подразделяются на солеобразующие и несолеобразующие.
Несолеобразующие оксиды, как видно из их названия, не способны взаимодействовать с кислотами или основаниями с образованием солей. К ним относятся N2O, NO, SiO, CO и некоторые другие оксиды.
Солеобразующиеоксиды,всвоюочередь,подразделяются на основные, кислотные и амфотерные.
5
Основными называютоксиды, взаимодействующие с кислотами (или с кислотными оксидами) с образованием солей. Основными могут быть оксидытолько типичных металлов: Na2O, K2O, CaO, SrO и др. Присоединяя (непосредственно или косвенно) воду, основные оксиды образуют основания.
Кислотныминазываютоксиды,взаимодействующиесоснованиями (или с основными оксидами) с образованием солей. Присоединяя (непосредственно или косвенно) воду, кислотные оксидыобразуюткислоты.Кислотныеоксидыобразуютнеметаллы: SO2, SO3, P2O5, N2O5, CO2, а также некоторые металлы, находящиеся в высокой степени окисления (+5 и выше), например, CrO3, Mn2O7. Оксид кремния (IV) SiO2 — тоже кислотный оксид, хотя он не взаимодействует с водой, ему соответствует кремниевая кислота H2SiO3, которую можно получить из SiO2 косвенным путем. Один из способов получения кислотных оксидов — отнятие воды от соответствующих кислот, поэтому кислотные оксиды иногда называют ангидридами кислот.
Амфотерными называются оксиды, образующие соли при взаимодействии как с кислотами (кислотными оксидами), так и с основаниями (основными оксидами). Амфотерными, в большинстве своем, являются оксиды металлов со степенями окисления +3, +4, значительно реже со степенью окисления +2. Амфотерные оксиды сочетают в себе свойства и основных и кислотных оксидов, а соответствующие им гидроксиды также являются амфотерными. Следует отметить, что все амфотерные оксиды в воде практическинерастворимы,поэтомуамфотерныегидроксиды можно получить только косвенным путем. Наиболее известными амфотерными оксидами являются: ZnO, BeO, SnO, PbO,
Al2O3, Cr2O3 и др.
Среди соединений элементов с кислородом существуют вещества, которые к оксидам можно отнести только по составу, а по строению и свойствам к солям. К таким веществам относятся пероксиды металлов, в которых степень окисления кислорода равна –1. В отличие от оксидов, в пероксидах атомы кислорода непосредственно соединяются друг с другом:
H2O2 |
(H—O—O—H) — пероксид водорода; |
Na2O2 |
(Na—O—O—Na) — пероксид натрия; |
6

O
CaO2 Ca |
— пероксид кальция. |
O
По своей природе пероксиды представляют собой соли очень слабой кислоты — пероксида (перекиси) водорода Н2О2.
Номенклатура химических соединений элемента с кислородом развивалась и складывалась по мере накопления фактического материала. Сначала, пока количество соединений было невелико,широкоиспользовалисьтривиальныеназвания,специфические для каждого соединения, не отражающие состава, строения и свойства вещества, — сурик, глет, жженая магнезия, железная окалина, веселящий газ, белый мышьяк (Pb3O4, PbO, MgO, Fe3O4, N2O, As2O3 соответственно). На смену такой номенклатуре пришла полусистематическая — стали указывать количество атомов кислорода, появились термины: закись, окись; ангидрид.
Внастоящее время существуют две номенклатуры — русская
имеждународная.Согласнорусскойноменклатуре,еслиэлемент проявляет только одну степень окисления, то его соединение с
кислородом, независимо от состава, называют окисью (K2O — окись калия, CaO — окись кальция, Аl2О3 — окись алюминия). Если элемент проявляет переменную степень окисления, то его соединение с кислородом, отвечающее низшей степени окисле-
ния элемента, называют закисью, например, Cu2O — закись меди, FeO — закись железа, MnO — закись марганца. При образовании элементом (Э) нескольких соединений с кислородом дляих наименованиякслову«окись» прибавляетсяприставка из русских числительных, которые означают число атомов кислорода, приходящееся на один атом элемента. Например:
Э О—полуокись;ЭО—одноокись;Э О |
—полутораокись;ЭО |
2 |
||
2 |
2 |
3 |
|
|
— двуокись; Э2О5 — полупятиокись; ЭО3 — трехокись; Э2О7 — полусемиокись; ЭО4 — четырехокись. Кислотные и некоторые амфотерные окислы иногда называют ангидридами соответствующих кислот, в случае, если неметалл образует два ангидрида, то названия отличаются суффиксами в зависимости от степени окисления неметалла:низшая —суффикс «ист», высшая— «н».
7
4 |
6 |
Например: SO2 — сернистый ангидрид, SO3 — серный ангид-
рид.
По международной номенклатуре ИЮПАК кислородные соединения элемента называют оксидами (K2O — оксид калия, Na2O—оксиднатрия).Для обозначения составаоксидов элементов с переменной степенью окисления возможно либо использовать префиксы, образованные от греческих числительных, либо указывать степень окисления элемента римскими цифрами (система Штока). Например: N2O (I) — оксид диазота или оксид азота (I); NO (II) — монооксид азота или оксид азота (II); NO2 (IV) — диоксид азота или оксид азота (IV), N2O5 (V) — пентаоксид диазота или оксид азота (V).
1.2. Химические свойства и способы получения оксидов
Деление солеобразующих оксидов на основные, кислотные и амфотерные обусловлено различием в их химических свой-
ствах.
1. Основные оксиды взаимодействуют с кислотами (a) и кислотными оксидами (б):
a) CuO + H2SO4 = CuSO4 + H2O; Na2O + 2HCl = 2NaCl + H2O;
б) 3K2O + P2O5 = 2K3PO4; CaO + CO2 = CaCO3.
2. Основные оксиды, образованные щелочными и щелочноземельными металлами, при взаимодействии с водой образуют растворимые основания — щелочи:
Na2O + H2O = 2NaOH; CaO + H2O = Ca(OH)2.
Взаимодействие сопровождается выделением большого количества тепла.
3. Кислотные оксиды взаимодействуют с основаниями (а) и основными оксидами (б):
а) SO3 + 2NaOH = Na2SO4 + H2O; CO2 + Ca(OH)2 = CaCO3 + H2O;
SiO2 + 2NaOH = Na2SiO3;
б) SO3 + Na2O = Na2SO4; CO2 + CaO = CaCO3; SiO2 + CaO = CaSiO3.
4. Все кислотные оксиды, кроме оксида кремния (IV) SiO2, взаимодействуют с водой с образованием кислот:
SO3 + H2O = H2SO4;
8
CO2 + H2O = H2CO3;
N2O5 + H2O = 2HNO3.
5. Амфотерные оксиды, сочетая в себе свойства основных и кислотных оксидов, взаимодействуют и с кислотами (а) и со щелочами (б):
а) Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O; ZnO + 2HCl = ZnCl2 + H2O;
T
б) Al2O3 + 2NaOH =2NaAlO2 + H2O;
алюминат натрия
T
ZnO + 2KOH =K2ZnO2 + H2O.
цинкат калия
6. Амфотерные оксиды при нагревании могут взаимодействовать с кислотными и основными оксидами с образованием солей:
T
Cr2O3 + 3SO3 =Cr2(SO4)3;
T
SnO + Na2O =Na2SnO2.
Основных способов получения оксидов несколько. 1. Окисление простого вещества кислородом:
T |
T |
4Li + O2 = 2Li2O; 2Cu + O2 =2CuO; |
S + O2 =SO2. |
2. Термическое разложение оснований (а), кислородсодержащих кислот (б) и их солей (в):
T T
а) Cu(OH)2 =CuO + H2O; Mg(OH)2 =MgO + H2O;
T T
б) H2SO3 =SO2 + H2O; 4HNO3 =4NO2 + 2H2O +O2
(некоторые кислоты разлагаются даже при низких температурах: Н2СО3 = Н2О + СО2 );
T |
T |
|
в) СаСО3 =СаО + СО2 ; 2Сu(NO3)2 =2CuO + 4NO2 + O2 . |
||
3. Горение сложных веществ: |
|
|
T |
T |
+ 2Н2О. |
2Н2S + 3O2 = 2SO2 + 2H2O; |
СН4 + О2 = СО2 |
|
4.Взаимодействиекислот,обладающихокислительнымисвойствами,сметалламиинеметаллами. Например, концентрированная серная кислота при действии восстановителей образует оксиды, в которых сера проявляет более низкую степень окисления, чем в кислоте:
6 |
4 |
Сu + 2Н2 SO4 (конц.) |
= CuSO4 + SO2 + 2H2O; |
6 |
4 |
С + 2Н2 SO4 (конц.) |
= СО2 + 2SO2 + 2H2O. |
9

2.ОСНОВАНИЯ
Сточки зрения теории электролитической диссоциации основания (основные гидроксиды) — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-
ионы ОН–. Общая формула оснований — М(ОН)n. При графическом изображении формул оснований следует помнить, что атом кислорода одной валентной связью соединен с атомом водорода, а другой — с атомом металла (или группой атомов
NH4).
KOH |
Ba(OH)2 |
Fe(OH)3 |
|
OH |
OH |
K—O—H |
Ba |
Fe —OH |
|
OH |
OH |
2.1. Классификация и номенклатура оснований
По агрегатному состоянию все основания представляют собой твердые вещества различного цвета: основания, образованные щелочными и щелочноземельными металлами — белые; гидроксиды многих d-металлов окрашены (Cu(OH)2 — голубой, Fe(OH)3 — бурый, Ni(OH)2 — зеленый).
По растворимости в воде все основания делятся на растворимые и нерастворимые. К растворимым в воде основаниям относятся гидроксиды щелочных (Li, Na, K, Rb, Cs, Fr) и щелочноземельных металлов (Ca, Sr, Ba) — их называют щелочами — и гидроксид аммония (NH4OH). Среди щелочей хуже других растворяются в воде LiOH и Ca(OH)2. Гидроксиды остальных металловпрактическинерастворимы вводе:Cu(OH)2,Fe(OH)3, Mg(OH)2 и др.
Спозицийпротоннойтеориикислотиоснованийкоснованиям относятся вещества, способные присоединять ионы водорода, т.е. быть акцепторами протонов. В зависимости от числа протонов, которые может присоединить основание, различают одно-
кислотные основания: LiOH, KOH, NaOH и т.п.; двухкислот-
ные: Ba(OH)2, Fe(OH)2 и т.п.; трехкислотные: Fe(OH)3, Bi(OH)3. Двух- и трехкислотные основания называются многокислотными основаниями. Кислотность также можно определить по количеству гидроксид-ионов в молекуле основания.
10
