
Лекции / Лекции (Павлова) / L6
.docЛекция №6.
Оказалось, что не только механическое тепло переходит в работу, но и наоборот, а также все энергии переходят в друг друга в строго эквивалентном отношении.
Д![]() ля
циклического процесса принцип
эквивалентности записывается в виде:
ля
циклического процесса принцип
эквивалентности записывается в виде:
Закрытая система. Алгебраическая сумма тепла и работы призарных способах перехода системы из первого состояния в другое сохраняет постоянную величину, в циклическом процессе=0, в первом законе термодинамики постулируется связь этой суммы с изменением внутренней энергии системы (U).
Внутренняя энергия зависит только от состояния системы. Теплота, подводимая к системе, идет на изменение ее внутренней энергии и совершение работы. Первое начало термодинамики можно сформулировать так: в любом процессе в приращении внутренней энергии системы (∆U=U2-U1) равно количеству сообщаемой системы теплоты “–” количество работы, совершенной системой.
∆U=Q-A
Свойства ∆U: ее изменение определяется только начальным и конечным состоянием системы.

∆U – функция состояния – не зависит от пути проведения процесса.
Функция состояния.
Функция от параметров состояния, если ее значения зависят только от этих параметров, и не определяется процессами предшествующими этапу состояния. A и теплота не являются функциями состояния системы, они зависят от пути процесса, определяют следующим образом
dU=Q-A
с и
значит![]()
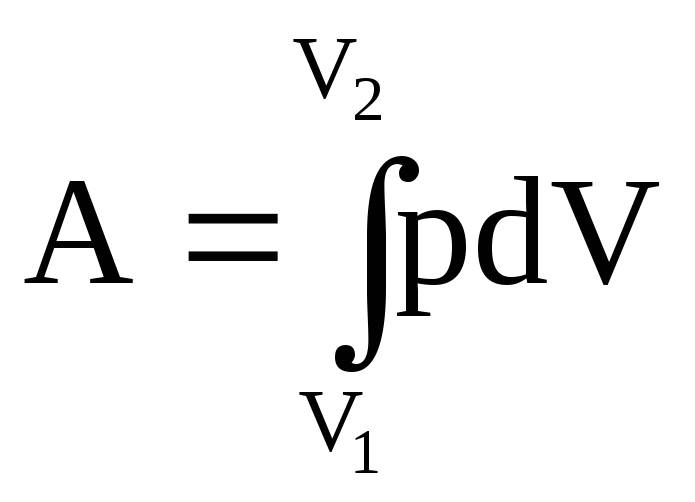
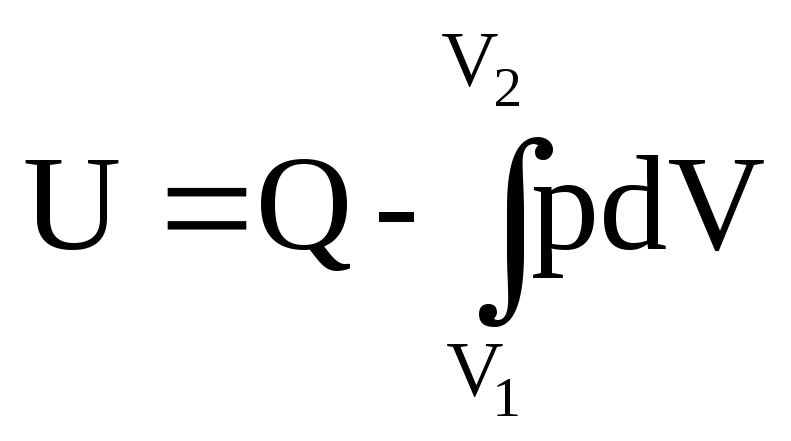 dU=-pdV
dU=-pdV
Другие виды работы, которые не связаны с изменением объема системы – полезные работы.
Р
Поверхностное
натяжение абота
по поднятию силы тяжести: A=pdh=mgdh
абота
по поднятию силы тяжести: A=pdh=mgdh
Р абота
по переносу заряда между двумя
потенциалами: A=dl
абота
по переносу заряда между двумя
потенциалами: A=dl
Работа по изменению поверхности жидкости на величину dS: A=….dS
В формулировке Гельмгольца первое начало термодинамики записывается так:
Полезные
работы


 dU=Q-pdV-A
dU=Q-pdV-A
Н аиболее
полезной работой называется та, которой
система может получить за счет химических
превращений.
аиболее
полезной работой называется та, которой
система может получить за счет химических
превращений.
dV – экстенсивное свойство
рвн=рсист+р
рвнрсист , значит в равновесных условиях р -внутренние свойства.
Закон сохранения энергии, связывает ее изменения в системе с величинами, характеризующими процесс, а не описываемыми состояние системы.
Справа стоят величины (интенсивные: p, ) относящимися к внешней среде, но для описания свойств системы нужны ее параметры. Для экстенсивных величин V, q – в силу закона сохранения …. взаимосвязь
dVвнеш=-dVсист
dlвнеш=-dlсист
на границе может возникать перепад давления, разделять потенциал, наличие этих перепадов – причина протекания процессов.
Только при равновесии интенсивные параметры на границе система – внешняя среда равные друг другу.
iвнеш=iсист+с.
Учитывая эту взаимосвязь для закона сохранения можно записать следующее выражение:
DUсист=Qвнеш.среда - pсистdVсист - dlсист
На основе первого закона термодинамики в общем случае нельзя выразить Qвнеш через параметры системы.
 Закрытая
система. Для более частого случая
изолированной системы имеем: Q=0
(нет теплообмена), А=0.
В соответствии с первым законом
термодинамики dU=Q-A;
dU=0
U=const, т.о.
внутренняя энергия изолированной
системы – величина постоянная.
Закрытая
система. Для более частого случая
изолированной системы имеем: Q=0
(нет теплообмена), А=0.
В соответствии с первым законом
термодинамики dU=Q-A;
dU=0
U=const, т.о.
внутренняя энергия изолированной
системы – величина постоянная.
обмен веществ с внешней средой
Открытая система. Внутренняя энергия зависит от массы.
Первый закон термодинамики записывается в виде:
∆U=Q-A+Eм
dU=Q-A+dEм
Помимо работы и теплообмена возможны другие механизмы обмена энергией между системой и внешней средой. Например за счет взаимодействия с квантами лучистой энергии, электромагнитным полем …, в этом случае в правой части в одно значение т/д приписывают дополнительно составляющие слагаемые (E*).
∆U=Q-A+Eм+E*
dU=Q-Eм+dE*
Приложение первого начала термодинамики к простейшим процессам.
-
Изотермическое, обратимое расширение идеального газа.
И (pV)T=const![]()
К анализу опыта Гейлюссака можно подойти с т. зрения первого начала т/д, после установление равновесия в системе не наблюдалось изменений температуры, т.к. во втором сосуде р=0, при открытии газа A не совершалось. Q=0 A=0 не происходило изменений внутренней энергии, т.е. dU=0, и (….U/….V)T=0
∆=Q-A
PV=nRT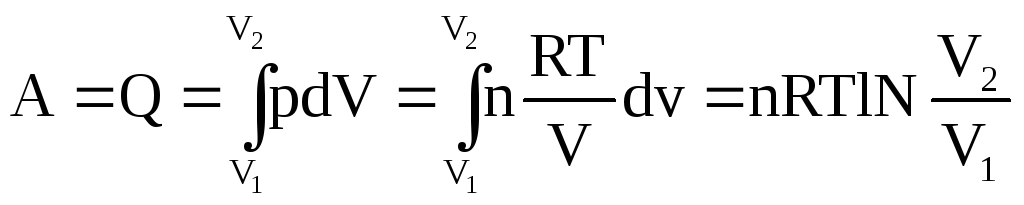
![]()
![]()
PV=RT
Работа при обратном изотермическом расширении газа, тем меньше, чем меньше температура
-
И
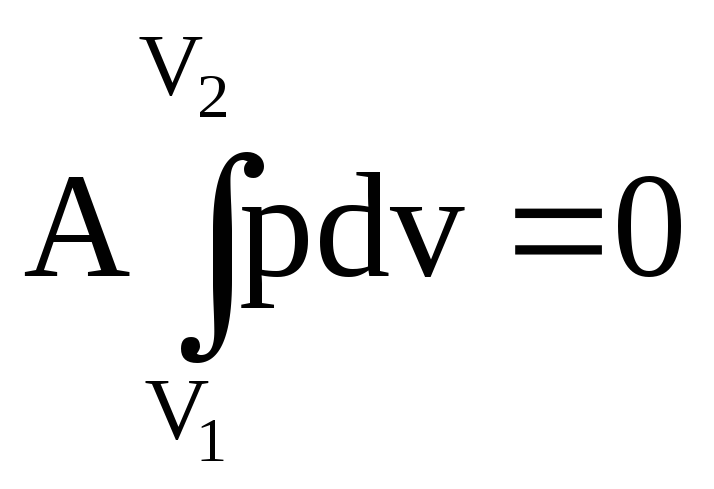 зохорический
процесс. V=const,
т.е. ∆V=0. Отсюда работа
расширяется.
зохорический
процесс. V=const,
т.е. ∆V=0. Отсюда работа
расширяется.
значит вся теплота сообщаемая системе идет на изменение внутренней энергии.
∆U=QV
В изохорическом процессе теплота является мерой измерения внутренней энергии и в этом случае эта теплота приобретает свойства функции состояния.
-
И
A’=0 если только работа расширения
зобарический процесс. p=const
Q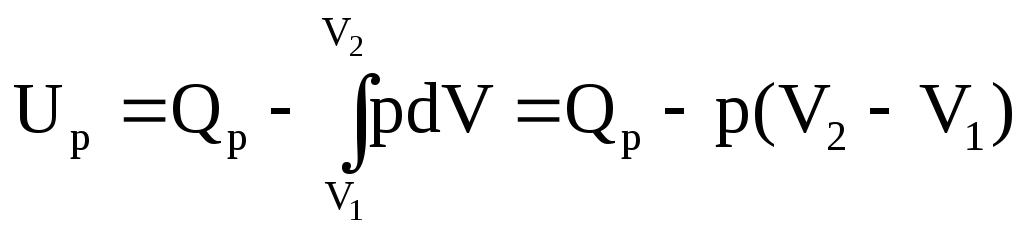 p=∆Up+p(V2-V1)=U2-U1+pV2-pV1=(U2+pV2)-(U1+pV1)
p=∆Up+p(V2-V1)=U2-U1+pV2-pV1=(U2+pV2)-(U1+pV1)
Справа стоит функция состояния U, p и V – свойства системы, не зависящие от процесса, а (U+pV) – энтальпия.
