
- •Электрический баланс ванны электроэкстракции Никеля
- •Введение
- •Электродные реакции
- •1.2 Суммарная электрохимическая реакция
- •2.Составы электролитов для электроэкстракции никеля
- •2.1 Сульфатный электролит
- •3.Расчет электрического баланса ванны электроэкстракции
- •3.1Исходные данные для расчета электрического баланса. Расчет электрического баланса
- •3.1.1 Расчет равновесных электродных потенциалов анодной и катодной реакций
- •3.1.2 Расчет перенапряжений катодной и анодной реакции
- •3.1.3 Расчет падения напряжения в электролите
- •3.1.4 Расчет падения напряжения в диафрагме
- •3.1.5 Расчет падения напряжения в теле электрода
- •3.1.6 Расчет напряжения на ванне с учетом падения напряжения в контактах
3.1.1 Расчет равновесных электродных потенциалов анодной и катодной реакций
Расчет равновесного потенциала катодной реакции проводим по уравнению Нернста (3.3):
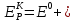

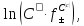 (3.3)
(3.3)
где
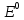 - стандартный электродный потенциал,
В;
- стандартный электродный потенциал,
В;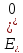 = -0,25 В
= -0,25 В
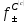 –среднеионный
коэффициент активности.
–среднеионный
коэффициент активности.
Для
определения коэффициента активности
используем график зависимости
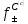 –C
(рис. 2) [2].
–C
(рис. 2) [2].
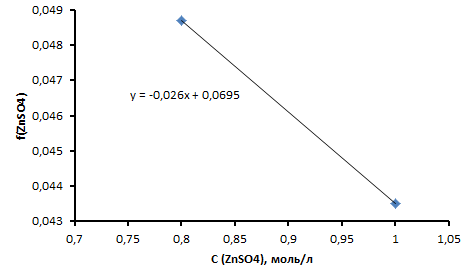
Рисунок
2 - Зависимость
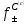 –C
для определения коэффициента активности
–C
для определения коэффициента активности
Найдем коэффициент активности:
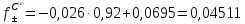 .
.
Подставим значения в уравнение (3.3):
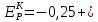
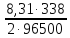
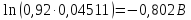
Расчет равновесного потенциала анодной реакции проводим по формуле (3.4):
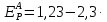
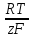
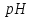 (3.4)
(3.4)
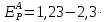
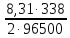
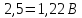
3.1.2 Расчет перенапряжений катодной и анодной реакции
Для расчета катодного перенапряжения используем уравнение смешанной кинетики (3.5):
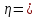
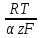
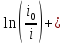
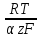
 (3.5)
(3.5)
где,
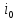 – ток обмена,
– ток обмена,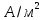 ;
;
 –коэффициент
переноса;
–коэффициент
переноса;
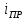 –предельный
ток,
–предельный
ток,
 ;
;
Для нахождения величины предельного тока воспользуемся уравнением (3.6):
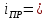
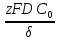 ,
(3.6)
,
(3.6)
где,
D
– коэффициент диффузии,
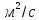
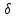 –толщина
диффузионного слоя;
–толщина
диффузионного слоя;
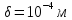 ;
;
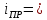
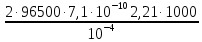 =
2991,48
=
2991,48
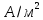
Величину
тока обмена считаем на основе справочных
данных. Для системы, содержащей 1М
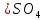
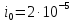
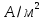 [4]. По формуле (3.7) рассчитаем значение
стандартного тока обмена для этой
системы:
[4]. По формуле (3.7) рассчитаем значение
стандартного тока обмена для этой
системы:
 (3.7)
(3.7)
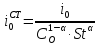 =
=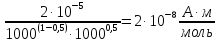
Подставим найденное значение стандартного тока обмена в уравнение (3.7) и получим величину тока обмена для заданного электролита:

Подставив найденные значения в уравнение (3.5), найдем перенапряжение катодной реакции:
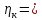
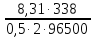

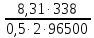
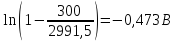
Для расчета анодного перенапряжения используем уравнение Тафеля (3.8):
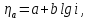 (3.8)
(3.8)
где a – коэффициент уравнения Тафеля, а=1,17
b – коэффициент уравнения Тафеля, b=0,134 [5]
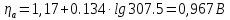
3.1.3 Расчет падения напряжения в электролите
Для расчета падения напряжения в электролите воспользуемся формулой (3.9)[5]:
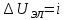
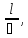 (3,9)
(3,9)
где, l – расстояние между электродами, м;
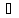 –электропроводность
раствора, См/м;
–электропроводность
раствора, См/м;
Найдем расстояние между электродами по формуле (3.10): у Вас два слоя электролита –католит и анолит
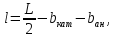 (3.10)
(3.10)
где,
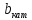 – толщина катода, м;
– толщина катода, м;
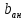 – толщина
анода, м;
– толщина
анода, м;
L – расстояние между одноименными электродами, м
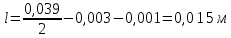
Для расчета падения напряжения в электролите необходимо найти электропроводность раствора. Найдем суммарную эквивалентную концентрацию раствора по формуле (3.11):
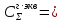
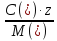

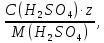 (3.14)
(3.14)
где, C – концентрация компонента, г/л
М – молярная масса, г/моль
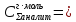
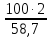
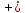
 4,42
4,42 ;
;
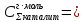
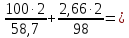 3,45
3,45
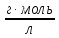 ;
;
Электропроводность растворов найдем по формуле (3.15). Для этого необходимо найти величины удельной электропроводности λ [4].
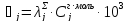 (3.15)
(3.15)
Для
нахождения удельной электропроводности
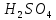 воспользуемся справочными данными
(табл. 7) [4].
воспользуемся справочными данными
(табл. 7) [4].
Таблица
7 – Справочные данные для раствора
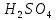
|
ω, % |
ρ, г/дм3 |
|
λ∙ |
|
7 |
1045,4 |
0,95 |
206,9 |
|
10 |
1066,3 |
1,38 |
196,4 |
|
14,56 |
1098,1 |
2,07 |
180,0 |
|
19,8 |
1134,6 |
2,91 |
156,5 |
|
25,31 |
1172,99 |
3,84 |
131,40 |
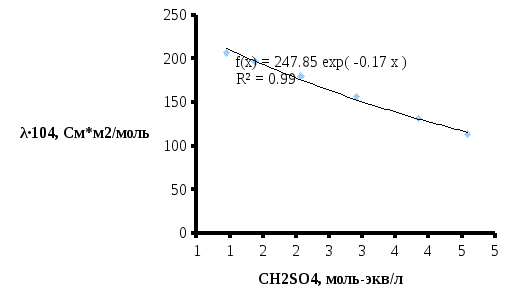
Рисунок
3 –Зависимость удельной электропроводности
от эквивалентной концентрации
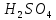
Поскольку католит и анолит разделены диафрагмой необходимо рассчитать электропроводность для двух составов электролита.
Для нахождения эквивал. электропроводности католита используется уравнение линии тренда (рис. 2).
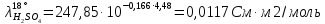
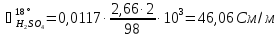
Для пересчета на заданную температуру используем формулу (3.16):
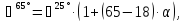 (3.16)
(3.16)
где,
α – температурный коэффициент;
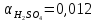 ;
;
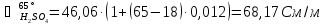
Для
нахождения удельной электропроводности
 воспользуемся
справочными данными (табл. 8) [4].
воспользуемся
справочными данными (табл. 8) [4].
Таблица
8 - Справочные данные для раствора
|
ω, % |
ρ, г/дм3 |
Cэкв, моль/л (18°) |
λ∙ |
|
3,73 |
1038,2 |
0,50 |
30,6 |
|
7,2 |
1078,9 |
1,00 |
25,4 |
|
13,46 |
1152,1 |
2,01 |
19,25 |
|
19,01 |
1217,1 |
2,99 |
15,07 |
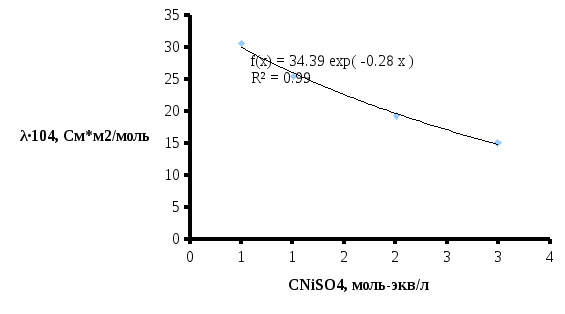
Рисунок
4 – Зависимость удельной электропроводности
от эквивалентной концентрации

Для расчета удельной электропроводности используется уравнение линии тренда (рис. 4).
Рассчитаем удельную электропроводность анолита:
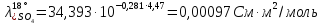

Рассчитаем удельную электропроводность католита:
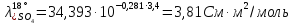
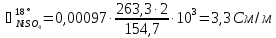
Пересчет
на заданную температуру производим по
формуле (3.16) при α(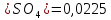 :
:
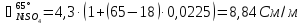
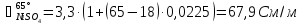
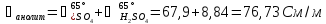
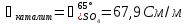
Рассчитаем падение напряжения в электролите по формуле (3.9):
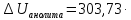
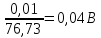
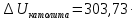



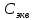 ,
моль/л
,
моль/л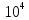 ,
См∙м2/моль
,
См∙м2/моль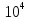 ,
См∙м2/моль
,
См∙м2/моль