
фотохимия
.pdf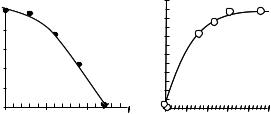
Активность СОД (% к исходной)
|
Инактивация СОД |
|
Фотореактивция СОД |
||||||||
|
|
при pH 5.9 |
|
|
|
|
при λ = 632,8 nm |
|
|||
|
|
|
|
|
100 |
|
|
|
|
|
|
80 |
|
|
|
|
80 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
60 |
|
|
|
|
|
|
40 |
|
|
|
|
40 |
|
|
|
|
|
|
20 |
|
|
|
|
20 |
|
|
|
|
|
|
0 |
0 |
50 |
100 |
150 |
0 |
0 |
20 |
40 |
60 |
80 |
100 |
|
Время инкубации, мин |
|
|
|
Время облучения, с |
||||||
Рис. 4.9. Инактивация (А) и фотореактивация (Б) супероксиддисмутазы.
В опытах с изолированной эритроцитарной Cu-Mn-супероксиддисмутазой было показано, что снижение рН раствора приводит к инактивации фермента (рис. 4.9, слева), тогда как последующее облучение инактивированного при pH 5,9 фермента светом ГНЛ наблюдалась полная его реактивация (рис. 4.9, справа). Это явление может наблюдаться, по-видимому, и в живых организмах. Если в каком-то локусе организма человека кислотность среды уменьшается (что вообще-то типично для очагов нарушения нормальной жизнедеятельности клеток), то можно ожидать в данном месте постепенного снижения активности СОД из-за низкой рН.
Изучение механизма действия лазера на инактивированную СОД показало, что инактивация фермента в кислой среде связана с протонированием гистидина в активном центре фермента, тогда как фотореактивация вызвана депротонированием этого аминокислотного остатка (и восстановлением активности фермента) в результате изменения pK в возбужденном электронном состоянии.
+
His-61 (активная СОД) →+ H (pH 5,9) Неактивная СОД
←+
−H или свет
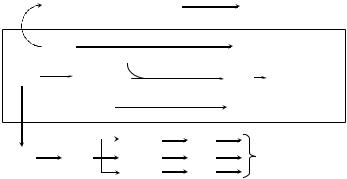
Как будет подробнее изложено в главе Error! Reference source not found., многие патологические состояния сопровождаются или вызываются избыточным образованием свободных радикалов в живых организмах. При этом основной первичный радикал, называемый супероксидом, представляет собой результат одноэлектронного восстановления молекулярного кислорода и образуется главным образом либо цитоплазматическими мембранами клеток в результате восстановления кислорода НАДФH, которое катализируется ферментным комплексом НАДФH оксидазой, либо внутренней мембраной митохондрий при нарушенном транспорте электронов в дыхательной цепи (см. раздел Error! Reference source not found.). На рисунке 4.10. приведена схема метаболизма супероксидного радикала в норме и при патологии.
21
5 |
|
OONO (пероксинитрит) |
|
Интоксикация |
|
||||||
|
|
.NO |
|
|
1 |
|
|
Вазодилатация |
Рис. 4.10 Судьба |
||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
Cl¯ |
миеллопероксидаза |
|
||||
|
|
СОД |
|
Антимикробное |
супероксидного радикала и |
||||||
.OO¯ |
|
||||||||||
O2 |
+ H2O2 |
|
|
|
ClO¯ |
||||||
|
|
2 |
|
|
3 |
|
действие |
нитроксида в норме и |
|||
6 |
|
|
|
|
4 |
каталаза |
Детоксикация H2O2 |
патологии. |
|||
|
|
|
|
|
пероксидазы |
|
|||||
|
|
7 |
|
|
LOOH |
8 |
LO . |
|
|
|
|
|
|
|
|
9 |
|
|
|
||||
Fe3+ |
Fe2+ |
HOOH |
HO. |
|
Токсическое |
|
|||||
|
|
|
|||||||||
|
|
|
|
|
HClO |
10 |
HO. |
|
действие |
|
|
1 – 4 – Реакции, протекающие в нормальных условиях, 5 – взаимодействие супероксида с оксидом азота, приводящее к появлению цитотоксических продуктов, 6 – 10 — восстановление супероксидом ионов железа и выход двухвалентного железа в клеточный сок, приводящий к индукции образования вторичных, цитотоксических свободных радикалов. Супероксиддисмутаза, удаляя супероксид, препятствует протеканию реакций 5 и 7, ключевых для развития патологических состояний в живых клетках и организме.
Центральную роль в развитии большого числа патологических состояний играют две реакции: взаимодействие супероксида с оксидом азота (при этом образуется весьма цитотоксичное соединение пероксинитрит) и восстановление супероксидом слабо ионов трехвалентного негеминового железа до свободных ионов двухвалентного железа (что приводит к образованию весьма вредных вторичных радикалов гидроксила и липидов). Супероксиддисмутаза уменьшает концентрацию супероксидного радикала ·O2–, катализируя реакцию дисмутации (реакция 2 рис. 4.10) и тем самым препятствует протеканию вредных реакций 5 и 7.:
Таким образом, защитное действие СОД обусловлено снижением концентрации супероксид-радикала и последующим удалением перекиси в реакциях, катализируемых каталазой и пероксидазой.
Гипотеза о механизме действия НИЛИ объяснила большое число наблюдаемых эффектов (в частности, ускоренное заживление ран при облучении лазером) именно снижением концентрации супероксидного анион-радикала при восстановлении активности СОД, инактивированной при небольшом снижении pH, характерном для очагов ишемии и воспаления.
22
Как известно, СОД оказывает защитное действие при ишемии–реперфузии, при ряде инфекционных болезней, действии многих мутагенов и токсинов. В последнее время показано, что уменьшение концентрации О2- за счёт активации СОД может иметь отношение и к NO–опосредованной регуляции микроциркуляции крови. Окись азота (NO) — это природный свободный радикал, являющийся предшественником фактора расслабления эндотелия сосудов (EDRF, от Endothelium Derived Relaxing Factor). Источником NO является т.н. индуцибельная NO-синтаза лейкоцитов. Продукция оксида азота лейкоцитами происходит на фоне т.н. «кислородного взрыва» фагоцитов, проявляющегося в значительном увеличении образования активных форм кислорода и в первую очередь
супероксидного радикала. Радикалы NO и ·О2– способны к быстрому взаимодействию друг с другом с образованием пероксинитрита ONOO¯ (реакция 5 на схеме). Пероксинитрит обладает действием, противоположным оксиду азота. Так, если NO вызывает вазодилатацию сосудов, то ONOO¯ – вазоконстрикцию (сужение сосудов), если NO уменьшает адгезионные свойства клеток крови, то ONOO¯, наоборот, увеличивает адгезию лейкоцитов на эндотелий сосудов и взаимную агрегацию и т.д. Поэтому, активация СОД и, как следствие, уменьшение концентрации в системе О2¯ является фактором, обеспечивающим NO-зависимое улучшение микроциркуляции крови (по реакции 1).
В литературе можно встретить много примеров благотворного влияния СОД: (1) снижение образования радикалов и уменьшение повреждения миокарда при ишемии-реперфузии сердца, (2) увеличение на 30 % выживаемости крыс после внутривенного введения вируса гриппа этим животным, (3) уменьшение мутагенного действия хризолитового асбеста на изолированные лимфоциты человека под действием СОД, (4) уменьшение в присутствии СОД протеинурии, вызванной адриамицином друге.
Недавно появились новые работы о благотворном действии видимого света при нарушении работы сердца в рузультате ишемического повреждения. Известно, что повреждение сердца и мозга из-за недостатка кислорода в определенных участках этих тканей – основная причина смерти людей в развитых странах. Казалось бы, восстановление кровообращения должно уменьшить или предотвратить повреждение клеток и тканей, испытывающих недостаток кислорода. Однако еще в 80-е годы МакКорд и сотрудники показали, что реперфузия может вызвать дополнительное повреждение ткани (реоксигенационное повреждение), которое в значительной мере обусловлено дополнительным образованием активных форм кислорода, в частности, супероксида. Так при реперфузии сердца, некоторое время находившегося в состоянии ишемии (отсутствия кровообращения), происходит резкое ухудшение состояния органа, проявляющееся, прежде всего, в фибрилляции. Введение супероксиддисмутазы в перфузионную жидкость заметно уменьшает этот эффект, из чего делается вывод о том, что за реоксигенационное повреждение ткани в основном ответственны свободные радикалы. В работах В.А.
23
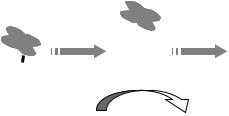
Монича и сотрудников было показано, что если вместо введения СОД производить облучение области сердца у лабораторных животных интенсивным светом, реперфузионное повреждение сердца и фибрилляция снимаются. Одновременно образование в тканях продуктов пероксидации липидов снижается до уровня неповрежденной ткани. Авторы объяснили эти эффекты явлением реактивации СОД под действием света.
4.7.3 Механизм 3: Фотолиз соединений, содержащих NO
Расслабление стенок сосудов (вазодилатация) является одним из наиболее четких эффектов лазерного облучения. Между тем хорошо известно, что в организме человека и животных расширение кровеносных сосудов происходит в результате активации гуанилат-циклазы, что в свою очередь зависит от присутствия свободного оксида азота (рис. 4.11). Таким образом, можно предположить, что при лазерном облучении происходит высвобождение оксида азота из каких-то депо, чувствительных к свету.
гемоглобин
NO-гемоглобин
hν
Сосудистая
релаксация
NO NO
Рис. 4.11. HbNO может служить донором NO при облучении лазерным светом. Возможно, это главный хромофор в механизме фоторелаксации кровеносных сосудов.
GTP cGMP
cGMP
Гуанилат-циклаза клетки гладкой мышечной ткани
Гипотеза о том, что свет может высвобождать NO из комплексов с гемсодержащими белками, была высказана на основании аналогии между NO и CO. Молекулы этих газов сходны по многим свойствам и образуют комплексы с (Fe2+)- гемовыми группами. Между тем комплексы CO c соединениями двухвалентного железа, включая CO-гемоглобин, весьма светочувствительны и распадаются под действием света с высоким квантовым выходом. Почему бы и комплексам NO с гемопротеинами не быть светочувствительными? Это предположение подтвердилось последующими экспериментами, на которых мы остановимся несколько позже.
4.8 Участие эндогенных фотосенсибилизаторов в действии лазерного излучения на клетки
В последнее время появилось много новых данных, подтверждающих рассмотренные три механизма действия лазерного излучения. Рассмотрим данные,
24

подтверждающие механизм 1 – фотодинамическое действие света в результате его поглощения эндогенными сенсибилизаторами.
Согласно гипотезе о механизме 1, первичным акцептором низкоэнергетического излучения в красной области спектра может служить гематопорфирин, который, как и другие порфирины, обладает поглощением в красной области спектра и при поглощении света способен вызывать пероксидацию липидов. На рисунке 4.12 приведен пример опыта, в котором показано накопление продуктов окисления липидов (МДА) при облучении клеток – лейкоцитов крови светом гелий-неонового (красного) лазера.
|
3 |
|
|
|
|
клеток |
2 |
|
|
|
|
/ 10 млн |
|
|
|
|
|
[МДА], нмоль |
1 |
|
|
|
|
0 |
10 |
20 |
30 |
||
|
|||||
|
|
Концентрация порфирина, мкМ |
|
||
Рис. 4.12. Фотопероксидация липидов при облучении лейкоцитов в присутствии гематопорфирина: 1 — облучение клеток светом гелий-неонового лазера, 2 — инкубация клеток в отсутствие облучения. По Г. И. Клебанову и сотр.
Накопление в клеточных мембранах продуктов перекисного окисления липидов способствует увеличению ионной проницаемости и в том числе для ионов Са2+. Действительно, было показано, что под действием лазерного облучения происходит увеличение содержания ионов Са2+ в цитозоле лимфоцитов (Т. Кару и сотр. 1989) и лейкоцитов (Г. И. Клебанов и сотр. 2001). При небольшом увеличении концентрации в гиалоплазме Ca2+ активирует различные внутриклеточные сигнальные реакции, что выражается, в случае клеток-фагоцитов в двух основных эффектах: проедстимуляции (прайминге) клеток и активации биосинтеза ряда белков-ферментов.
25
4.8.1 Прайминг фагоцитов
ХЛ ответ, % к необлученным клеткам
200 |
4,1 |
|
Рис. 4.13. Влияние облучения гелий- |
|
8,5 |
|
неоновым лазером суспензии клеток |
||
|
|
лейкомассы на ХЛ-ответ клеток в |
||
|
|
|
||
150 |
|
|
присутствии 10 мкл плазмы крови |
|
|
|
больных с бронхолёгочными |
||
|
|
|
заболеваниями. Плазма содержала |
|
|
|
|
разное количество эндогенных |
|
100 |
|
0 (контроль) порфиринов у разных больных. |
||
|
|
Концентрация порфиринов в пикомолях |
||
|
|
|
||
|
|
|
указана у кривых. В контроле к клеткам |
|
|
|
|
добавляли 10 мкл инкубационной среды |
|
50 |
|
|
(раствор Хенкса). По Г. И. Клебанову и |
|
|
|
сотр. |
||
0 |
2 |
4 |
||
6 |
||||
Доза, Дж / см2
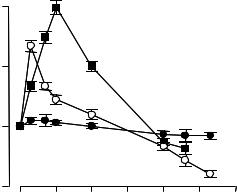
Как было показано работами Г.И. Клебанова и сотрудников (см. рис. 4.13), непосредственно после лазерного облучения наблюдается увеличение способности лейкоцитов (нейтрофилов крови и тканевых макрофагов) выделять активные формы кислорода при действии стимула (это явление называют предстимуляцией или праймингом). Увеличение активности фагоцитирующих клеток при лазерном облечении важно, например, в случае заживления ран, и это нашло свое применение в медицинской практике.
Важная особенность действия лазерного облучения состоит в том, что увеличение дозы облучения приводит к чрезмерному накоплению ионов кальция в клетках и к угнетению активности клеток. В сущности, эффективно только лазерное облучение вполне определенной интенсивности и длительности, а иначе эффект может быть небольшим или даже отрицательным. Различные пациенты, обладая, помимо прочего, разным содержанием гематопорфирина в тканях и крови, обладают различной чувствительностью к лазерному облучению и дозы должны подбираться индивидуально.
Данные на рисунке 4.13 подтверждают это правило. Изучали влияние лазерного облучения на функциональную активность фагоцитов в присутствии небольшого количества (10 мкл) плазмы крови двух групп пациентов с бронхолёгочными патологиями — хроническим бронхитом и пневмонией. Предварительно в плазме крови этих пациентов определяли концентрацию порфиринов спектрофлуориметрическим методом. Было обнаружено, что лазерное облучение клеток лейкомассы с плазмой крови, содержащей порфирин, в интервале доз лазерного облучения от 0 до 5 Дж/см2 сопровождается двухфазным изменением интенсивности хемилюминесценции: сначала наблюдается рост эффекта до некоторого максимального значения, затем уменьшение.
26
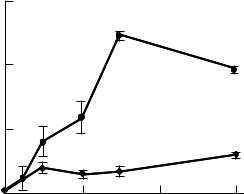
Доза лазерного облучения, приводящая к максимальному увеличению активности лейкоцитов, зависит от содержания порфирина в плазме. Чем меньше порфирина содержится в плазме, тем большая доза лазерного облучения необходима для достижения максимального потенциала фагоцитов. Так, в случае использования плазмы крови больного с бронхиальной астмой, содержащей порфирин в концентрации 0,85 нмоль/мл, максимальный хемилюминесцентный отклик в ответ на последующую после лазерного облучения стимуляцию специально обработанных оболочек бактерий дрожжевых клеток наблюдалась при дозе 0,26 Дж/см2. При исследовании крови другого больного с пневмонией легких, в плазме которого содержалось в 2 раза меньше порфирина (0,41 нмоль/мл), максимальный хемилюминесцентный отклик лейкоцитов наблюдали при дозе 1,05 Дж/см2.
Таким образом, наличие и количество эндогенных фотосенсибилизаторов как в составе самих гранулоцитов, так и в составе липопротеинов плазмы крови может быть важным фактором, определяющим влияние лазерного облучения на функциональную активность фагоцитов. Особенно это важно в процессе заживления ран и трофических язв, где определенный уровень бактерицидности является залогом очищения ран и ускорения процесса их заживления.
4.8.2 Усиление биосинтеза ферментов
В работах, проведенных Г.И. Клебановым и сотрудниками, было показано, что при облучении клеток запускаются процессы биосинтеза ферментов, активность которых увеличивается в течение 12–24 часов после облучения. В частности, было показано увеличение активности индуцибельной NO-синтазы и супероксиддисмутазы (СОД).
|
3 |
|
|
|
|
клеток |
2 |
|
|
|
|
/ 10 млн |
|
|
|
|
|
[МДА], нмоль |
1 |
|
|
|
|
0 |
10 |
20 |
30 |
||
|
|||||
|
|
Концентрация порфирина, мкМ |
|
||
Рис. 4.14. Для определения влияния лазерного облучения на синтез СОД суспензию клеток перитонеального экссудата крыс облучали гелий-неоновым лазером в интервале доз 0–1,5 Дж/см2, инкубировали определённое время и затем в лизате клеток определяли активность СОД. Было обнаружено, что с увеличением времени экспозиции (дозы) облучения наблюдается возрастание активности СОД. Введение в инкубационную среду ингибитора синтеза белков, циклогексемида предотвращало лазер-индуцированный синтез СОД в макрофагах.
27
Данные об активации СОД приведены на рис. 4.14. С увеличением времени экспозиции (дозы) облучения наблюдается возрастание активности СОД. Введение в инкубационную среду ингибитора синтеза белков, циклогексемида предотвращало лазер-индуцированный синтез СОД в макрофагах. В аналогичных экспериментах была показана активация синтеза NO в результате увеличения активности NO-синтазы. По мере увеличения дозы лазерного облучения происходило увеличение продукции оксида азота, которое при дозе 0,36 Дж/см2 достигало максимума и более чем в 3 раза превышало продукцию NO в контрольных образцах. Добавление специфического ингибитора NO-синтазы, N- монометиларгинина значительно уменьшало концентрацию продуцируемого оксида азота. Дальнейшее увеличение дозы светового воздействия приводило к ингибированию продукции NO.
Долговременное повышение активности этих белков приводит к расслаблению мелких кровеносных сосудов и улучшению кровоснабжения тканей. Кроме того, было обнаружено, что при лазерном облучении происходит усиленный биосинтез цитокинов и увеличивается пролиферация клеток. Все эти эффекты в эксперименте можно затормозить, если наряду с лазерное облучение проводить на фоне применения ингибиторов синтеза белка.
Значение долговременных эффектов лазерного облучения нельзя недооценивать. В подавляющем большинстве случаев в клинике при проведении процедур лазеротерапии световое воздействие осуществляется внутривенно, надвенно или накожно. В этих случаях биологическое действие проявляется совсем не там, где происходит облучение. Кроме того лечебный эффект не может быть таким же краткосрочным, как само облучение. Поэтому прямые эффекты, такие как фотосенсибилизированный прайминг или фотореактивация СОД, не могут объяснить всего спектра положительных эффектов лазеротерапии.
Таким образом, согласно представлению о фотодинамическом механизме благотворного действия лазерного излучения, оно является результатом инициации первичных, свободнорадикальных реакций, которые индуцируют активацию клеточного звена (лейкоцитов, фибробластов, кератиноцитов и др.), что выражается в увеличении бактерицидности, продукции белков и цитокинов и пролиферации клеток. Все эти события являются основой для формирования лечебного действия лазеротерапии (см схему на рис. 4.15).
28

|
Первичные |
|
|
|
|
Вторичные |
|
|
|
Клинические |
|
|
|
механизмы |
|
|
|
|
механизмы |
|
|
|
эффекты |
|
Рис. 4.15. Схема |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
стимулирующего |
|
|
|
|
|
|
|
|
|
|
|
|
действия |
|
|
|
|
|
|
|
|
|
|
|
|
низкоинтенсивного |
Инициация фото- |
|
1. |
Увеличение |
|
Заживление ран. |
|||||||
|
|
лазерного |
||||||||||
сенсибилизированных |
|
|
бактерицидности. |
|
Улучшение |
|||||||
|
|
|
излучения. |
|||||||||
свободно-радикальных |
|
2. |
Инициация синтеза |
|
микроциркуляции |
|||||||
реакций |
|
|
белков и цитокинов. |
|
крови. |
|
||||||
|
|
|
|
3. |
Активация |
|
Регенерация. |
|
||||
|
|
|
|
|||||||||
|
|
|
|
|
пролиферации клеток |
|
Иммуномодуляция |
|
||||
4.9 Фотолиз нитрозильных комплексов гемопротеинов
Перейдем теперь к доказательствам возможности механизма 3 действия лазеров: фотолиза нитрозильных комплексов гемопротеинов под действием низкоинтенсивного лазерного излучения. В опытах А.Н. Осипова и Г. Г. Борисенко был изучен фотолиза нитрозильных комплексов гемоглобина и цитохрома С.
4.9.1 Фотохимические реакции нитрозильных комплексов гемоглобина
Для проверки фоточувствительности нитрозильных комплексов гемоглобина к действию лазерного излучения был использован метод электронного парамагнитного резонанса (ЭПР). Спектр ЭПР, представленный на рис. 4.16, слева принадлежит нитрозильным комплексам гемоглобина (HbNO). Спектр имеет форму одиночной асимметричной линии с g-фактором 2,03 и представляет собой сумму сигналов от α- и β-цепей HbNO, в которых атомы Fe обладают шестью координационными связями. Облучение HbNO He-Cd лазером (λ = 441 нм) в дозе 20 кДж/м2 приводило к уменьшению сигнала ЭПР HbNO на 25–35%.
|
|
|
. |
1 |
|
|
|
|
|
|
отн. ед |
|
|
|
|
|
|
|
0,8 |
|
|
|
|
|
|
|
HbNO, |
|
|
|
|
|
|
g = 2,02 |
0,6 |
|
|
|
|
|
|
сигналаЭПР |
|
|
|
||
5 mT |
|
0,4 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Амплитуда |
0,2 |
|
|
|
18 кДж/м |
|
без |
|
Доза облучения, кДж/м2 |
|
||
облучение |
|
0 |
|
|
|
||
|
2 |
облучения |
|
0 |
20 |
40 |
60 |
Рис. 4.16. Сигналы ЭПР (слева) и дозовые зависимости фотолиза комплексов HbNO в растворе (треугольники), в эритроцитах (кружки) и в гемолизате (квадраты). Интенсивность излучения 170 Вт/м2.
29
Был изучен фотолиз нитрозильных комплексов гемоглобина непосредственно в эритроцитах (рис. 4.16, справа). Эффект излучения He–Cd лазера на эритроцитарный HbNO оказался весьма выраженным. Для разложения половины нитрозильных комплексов требовалась вчетверо меньшая доза, чем в случае очищенного HbNO.
Как в растворах гемоглобина, так и в эритроцитах исчезновение сигнала ЭПР комплексов HbNO можно объяснить их фотолизом по схеме:
hν + HbNO → Hb2+ + NO
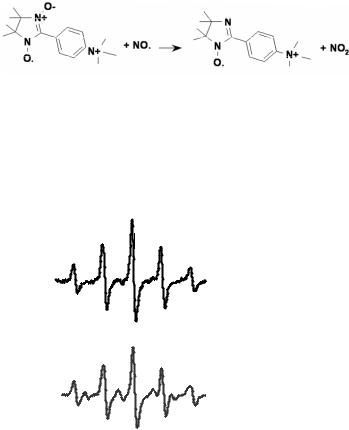
Для прямого обнаружения свободной NO, образующейся в результате фотодиссоциации, использовали спиновую ловушку — нитронил-нитроксильный радикал (ННР), который необратимо взаимодействует с NO с образованием иминонитроксильного радикала (ИНР) (рис. 4.17).
Рис. 4.17. Превращение нитронил-нитроксильного радикала в имино-нитроксильный радикал в присутствии NO (по
А.Н. Осипову и Г.Б. Борисенко, 1997, 2002).
Нитронил-нитроксильный |
Имино-нитроксильный |
радикал |
радикал |
При инкубировании HbNO и ННР без облучения, спектр ЭПР ННР не изменяется. После облучения в спектре ЭПР появлялись линии, соответствующие ИНР (они отмечены меткой “i”) и свидетельствующие об образовании свободного NO (рис. 4.18).
До облучения |
n g = 2,006 |
|
n |
n |
|
n |
ННР |
|
|
n |
||
|
|
|
||
|
|
|
|
|
5 mT |
|
|
|
|
После облучения |
i |
n |
Доза 215 кДж/М2 |
|
i |
|
|
|
|
|
n |
|
n |
|
n |
|
|
|
|
i |
|
i |
i i n |
|
i |
|
|||
Рис. 4.18. Спектры ЭПР нитроксилнитроксильного радикала (вверху) и смеси нитроксил-нитроксильного и иминонитроксильного радикалов (внизу).
ННР+ИНР
30
