
- •Лабораторная работа №1.1
- •5. Для записи наблюдений заготовить таблицу по образцу (табл.1).
- •Таблица 1
- •Изменение температуры при растворении соли с течением времени
- •Лабораторная работа № 1.2
- •Как следует из приведенного выше уравнения (2)
- •где mр-ра – масса раствора, представляющая собой сумму массы щелочи и массы кислоты, которые находятся по формуле m=Vρ, в которой V – объем раствора, мл; ρ – плотность раствора, г/мл.
- •mcт – масса стеклянного стакана, г
- •Таблица 3
- •Рис. 3. Изменение температуры от времени
- •Таблица 4
- •Концентрация растворов, моль/л
- •Объем растворов V, мл
- •Программа коллоквиума
- •Литература
- •Литература
- •Вопросы к защите работы.
- •Программа коллоквиума
- •Литература
- •Приложение
- •Вопросы к защите работы.
- •Программа коллоквиума
- •Литература
- •Лабораторная работа № 5.1
- •Суммарная электрохимическая реакция
- •Таблица 1
- •Таблица 2
- •Лабораторная работа № 5.2
- •Лабораторная работа № 5.3
- •Цель работы. Определение рН раствора с использованием хингидронного электрода. Сравнение полученного результата со значением рН, непосредственно измеренным на иономере с применением стеклянного электрода.
- •Условно хингидронный электрод можно записать как
- •Лабораторная работа №6.2
- •Литература
- •Литература
- •Рецензент: Б.И. Бортник
Вопросы к защите работы.
1.Написать гальванические элементы, которые необходимо составить для
определения потенциалов приведенных ниже электродов: Fe/FeSO4; Ni/NiCl2; Ag/AgNO3.
2.Рассчитать ЭДС полученных элементов в 0,1М растворах соответствующих солей.
3.Вывести уравнение для расчета потенциала хлорсеребряного электрода. Почему этот электрод используется в качестве электрода сравнения? Какие еще электроды могут быть использованы как электроды сравнения?
4.Зачем нужны солевые мостики? Почему они заполняются раствором хлористого калия?
Лабораторная работа № 5.3
Потенциометрическое определение рН растворов
Цель работы. Определение рН раствора с использованием хингидронного электрода. Сравнение полученного результата со значением рН, непосредственно измеренным на иономере с применением стеклянного электрода.
Оборудование.
1.Высокоомный милливольтметр.
2.Иономер.
3.Электроды: хингидронный, хлорсеребряный, стеклянный.
4.Солевые мостики.
5.Стаканы, емкостью 50мл – 3шт.
Реактивы.
1.Раствор с неизвестным рН.
2.Насыщенный раствор КСl для заполнения солевых мостиков.
3.Хингидрон.
Суть работы. Хингидронный электрод относится к окислительновосстановительным электродам. Для получения хингидронного электрода в стаканчик с впаянной в него платиной наливают исследуемый раствор и насыпают порошок хингидрона.
Хингидрон представляет собой эквимолярную смесь хинона С6Н4О2 (обозначим условно х) и гидрохинона (условно гх). При растворении в воде гидрохинон диссоциирует (в очень малой степени) с образованием сво-
43
бодных ионов водорода, а анион в результате реакции диспропорционирования превращается в хинон:
С6Н4(ОН)2 ↔С6Н4О2 + 2Н+ + 2е
Условно хингидронный электрод можно записать как
Pt/C6H4(OH)2, C6H4O2, H+
Возникающий в нем потенциал зависит от концентрации ионов водорода и определяется уравнением Нернста (4), в котором активности могут быть заменены на концентрации, поскольку, как сказано выше, степень диссоциации гидрохинона очень мала, следовательно, концентрация ионов Н+ тоже мала, и коэффициент активности равен единице (γ = 1). Тогда:
ϕPt / C6 H 4 (ОН )2 , С6 Н4О2 ,Н + = ϕ |
o |
|
(ОН )2 ,С6 Н4О2 ,Н+ |
+ |
0,059 |
lg |
Cx СH2 |
+ |
Рt / С6 |
Н4 |
|
|
|
||||
2 |
Cг х |
|
||||||
|
|
|
|
|
|
|
где Сх – концентрация хинона, моль/л; Сгх- концентрация гидрохинона, моль/л;
СН+ - концентрация ионов водорода, моль/л;
ϕ0 Pt / C6 H4 (ОН)2, С6Н4О2 ,Н+ - стандартный потенциал хингидронного электрода (0,699В).
В дальнейшем для простоты обозначим потенциал хингидронного электрода как ϕxг . Зная, что Сх = Схг, получаем
ϕхг =ϕхг0 + 0,059lgCH +
или
ϕхг =ϕхг0 −0,059 рН
где рН = - lgСН+
Отсюда может быть вычислено рН раствора
рН = |
ϕ0 |
−ϕ |
хг |
(12) |
хг |
|
|||
0,059 |
|
|||
|
|
|
||
Выполнение работы и обработка результатов эксперимента. Оп-
ределение рН с помощью хингидронного электрода. Для определения рН составляется гальванический элемент из хингидронного и хлорсеребряного электрода:
(-)Ag/AgClтв., KClнас.//H+, C6H4O2, C6H4(OH)2/Pt(+),
схематично представленный на рис.5.
44

4 |
5 |
(-) |
|
Аg/AgClтв., |
|||
(+) |
|
Рt |
KClнас. |
КСlнас. |
|
|
|
1 |
2 |
3 |
Рис. 5. Электрохимическая ячейка для определения рН раствора.
4,5 – солевые мостики, заполненные насыщенным раствором хлористого калия.
В стаканчик (1) наливают исследуемый раствор с неизвестным рН и насыпают (очень немного на кончике шпателя) порошок хингидрона. В стаканчиках (2) и (3) – насыщенный раствор хлористого калия (обратить внимание, что уровни жидкости во всех стаканчиках одинаковы).
Для установления равновесия собранный элемент выдерживают в течение 3-5мин, а затем замеряют ЭДС с помощью высокоомного милливольтметра, присоединяя концы проводов к соответствующим клеммам прибора. При этом хлорсеребряный электрод, являющийся в элементе отрицательным электродом, присоединяют к (-) клемме прибора, а хингидронный электрод, представляющий в элементе положительный электрод, присоединяют к (+) клемме прибора.
Записывают измеренную величину ЭДС элемента.
Согласно уравнению (1) полученная ЭДС представляет собой разность потенциалов
Е =ϕхг −ϕАg / AgClтв ,KClнас ,
откуда находят потенциал хингидронного электрода
ϕхг = Е +ϕAg / AgClтв ,КСlнас
(потенциал хлорсеребряного электрода в насыщенном растворе хлористого калия при стандартных условиях равен 0,222В).
По уравнению (12) рассчитывают рН исследуемого раствора.
Измерение рН раствора на иономере. Для измерения рН раствора на иономере (или рН-метре) используют элемент, состоящий из стеклянного электрода, потенциал которого зависит от концентрации ионов водорода в растворе, и хлорсеребряного, применяемого в качестве электрода сравнения.
Порядок измерения:
1.Включают прибор в сеть.
2.В стаканчик наливают исследуемый раствор.
45
3.Левой рукой отводят столик на 900.
4.Берут стаканчик в правую руку и подставляют его под электродную систему.
5.На экране высвечивается значение рН раствора.
Измеренное значение рН сравнивают со значением рН, рассчитанным по уравнению (12).
Вопросы к защите работы.
1.Что такое рН раствора.
2.С помощью каких электродов можно определить рН раствора потенциометрическим методом?
3.Что собой представляет хингидронный электрод.
4.Зачем нужен солевой мостик? Почему он заполняется раствором KCl? Можно ли использовать какой-нибудь другой электролит?
5.Что собой представляет стеклянный электрод.
Программа коллоквиума
1.Возникновение электродного потенциала на границе раздела двух фаз (металл - раствор). Зависимость электродного потенциала от температуры и концентрации. Уравнение Нернста. Нормальные электродные потенциалы по водородной шкале.
2.Типы электрохимических электродов. Электроды первого рода. Электроды второго рода. Окислительно-восстановительные электроды. Примеры электродов каждого типа. Хлорсеребряный электрод. Хингиронный электрод. Стеклянный электрод. Диффузионный потенциал.
3.Гальванические элементы и их электродвижущая сила. Классификация гальванических элементов. Химические и концентрационные элементы.
4.Компенсационный метод измерения ЭДС гальванических элементов. Измерение потенциалов электродов.
5.Ионное произведение воды. Водородный показатель растворов рН. Потенциометрический метод определения рН.
Литература
1.Мушкамбаров Н.Н. Физическая и коллоидная химия. М., ГОЭТАР-МЕД, 2001г., с.115-119, с.144-174.
2.Хмельницкий Р.А. Физическая и коллоидная химия. М., Высшая школа, 1988г., с.200-206, с.238-266.
3.Киреев В.А. Краткий курс физической химии. М., Химия, 1969г., с.401402, с.414-443.
46
Лабораторная работа №6
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Всякая поверхность раздела резко отличается по своим физико-хи- мическим свойствам от внутренних частей обеих граничащих фаз. Различие это заключается в том, что на поверхности раздела фаз имеется избыток свободной энергии.
В дисперсных и особенно в коллоидных системах удельная поверхность очень велика. Поэтому явления, происходящие на границе раздела фаз и называемые поверхностными, имеют огромное значение.
Эти явления наблюдаются на любой границе раздела, протекают самопроизвольно и приводят к уменьшению избытка свободной энергии поверхности. К ним относятся адсорбция, поверхностное натяжение и смачивание.
Лабораторная работа №6.1
Поверхностное натяжение и адсорбция
Молекулы, находящиеся в поверхностном слое вещества, испытывают неравноценное воздействие со стороны соприкасающихся фаз. Например, молекулы жидкости на границе раздела жидкость-пар, притягиваются значительно сильнее со стороны жидкости, чем со стороны пара. Вследствие этого молекулы поверхностного слоя обладают некоторой некомпенсированной свободной энергией.
Согласно второму закону термодинамики система наиболее устойчива при минимальной свободной энергии. Поэтому жидкость стремится сократить свою поверхность.
Сила, действующая в сторону уменьшения поверхности, отнесенная к единице длины линии, лежащей на границе раздела фаз, называется по-
верхностным натяжением (σ).
Равнодействующая сил притяжения, влияющих на молекулу поверхностного слоя жидкости, направлена внутрь жидкости, молекула как бы втягивается в жидкость. На преодоление этой втягивающей силы и перемещения молекул из объема на поверхность необходимо затратить работу. Поэтому поверхностное натяжение можно также определить как работу, затрачиваемую системой на образование единицы поверхности раздела фаз или эквивалентную ей свободную энергию, находящуюся на единице поверхности.
47
Поверхностное натяжение зависит от природы жидкости, от температуры, а также от концентрации растворов. В единицах СИ оно выражается в Дж/м2 или Н/м. Для различных жидкостей σ неодинаково, особенно велико поверхностное натяжение воды (7,3·10-2 н/м).
Цель работы. Определение поверхностного натяжения растворов, изучение зависимости поверхностного натяжения от концентрации раствора, вычисление величины адсорбции и построение изотермы адсорбции.
Оборудование.
1.Прибор для определения поверхностного натяжения растворов
(рис.1).
2.Мерная колба емкостью 50 мл.
3.Пипетка.
4.Бюретка.
5.Стакан емкостью 200 мл.
6.Колбы, 8 шт.
Реактивы.
1.Дистиллированная вода.
2.Изобутиловый спирт.
Суть работы. Для измерения поверхностного натяжения существует большое число экспериментальных методов. В данной работе используется метод Ребиндера – метод наибольшего давления пузырьков. Сущность этого метода заключается в определении давления, которое необходимо для отрыва пузырька воздуха от капилляра, погруженного в жидкость.
Это давление пропорционально поверхностному натяжению:
σ = K P |
(1) |
Коэффициент пропорциональности К является постоянной прибора и определяется по стандартной жидкости с известным поверхностным натяжением. Определение поверхностного натяжения методом наибольшего давления пузырьков производится с помощью прибора, изображенного на рис.1.
48

Рат
Рис.1. Схема установки:
1 – трубка с капиллярным кончиком;
2 – пробирка с исследуемой жидкостью;
3– манометр;
4– аспиратор;
5– кран;
6– исследуемая жидкость.
Спомощью аспиратора в пробирке над жидкостью создается разре-
жение. Под действием атмосферного давления (Рат) на конце капилляра постепенно формируется пузырек воздуха, и, при каком-то критическом разрежении в системе, пузырек проскакивает через жидкость.
При этом давление газа в пузырьке определяется первым законом Лапласа
P = 2rσ ,
где r – радиус капилляра.
Максимальное давление газа в пузырьке достигается при максимальном значении его радиуса, который соответствует радиусу капилляра.
В растворах изменение σ происходит при адсорбции так называемых поверхностно-активных веществ. Это обычно органические соединения, молекулы которых состоят из углеводородной цепочки и функциональной группы (-СООН, -ОН, -СОН и др.). Такие молекулы имеют сродство к полярной и неполярной фазам и на границе раздела фаз соответственно ориентируются.
Поскольку поверхностно-активные вещества понижают поверхностное натяжение, они выталкиваются из раствора на поверхность – адсорбируются на поверхности. Следовательно, способность вещества понижать поверхностное натяжение является причиной адсорбции.
49
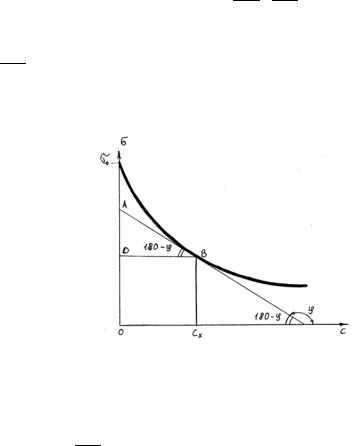
Между концентрацией адсорбированного вещества в поверхностном слое Г и концентрацией его в растворе С существует зависимость, которая описывается уравнением адсорбции Гиббса:
Г = − RTС ddCσ ,
где ddCσ - поверхностная активность. Для ее нахождения используют изотерму
σ = f(С) (рис.2.)
Рис.2. Зависимость поверхностного натяжения от концентрации раствора. σ0 – поверхностное натяжение чистого растворителя.
Графически ddCσ представляет собой тангенс угла наклона касатель-
ной, проведенной в точке В, соответствующей данной концентрации Сх.
dσ |
= tgϕ |
(3) |
|
dC |
|||
|
|
Перейдя к смежному острому углу СхFB, затем параллельномуABD, легко видеть, что ABD=180o-φ. Рассмотрим треугольник ABD.
tg ABD = tg(1800 |
−ϕ) = |
AD |
= |
|
AD |
(4) |
||||
|
|
Cx |
||||||||
|
|
|
|
|
BD |
|
||||
С другой стороны, tg(1800 −ϕ) = −tgϕ = − |
dσ |
|
|
(5) |
||||||
dC |
|
|||||||||
|
|
|
|
|
|
|
|
|||
Сравнивая уравнения (4) и (5), получим, что |
|
|
||||||||
|
dσ |
= − |
AD |
|
|
|
|
|
|
(6) |
|
|
Cx |
|
|
|
|
|
|||
|
dC |
|
|
|
|
|
|
|||
50
Подставим найденное выражение (6) для поверхностной активности в уравнение (2), получим
Г = |
AD |
, |
(7) |
|
RT |
||||
|
|
|
где R – универсальная газовая постоянная, равная 8,315 Дж/моль град; Т – температура, К.
Таким образом, из уравнения (7) следует, что для расчета адсорбции необходимо графически найти величину отрезка AD. Рассчитав Г, легко построить изотерму адсорбции Г=f(с) (рис.3).
Г 
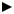 С
С
Рис.3. Изотерма адсорбции Гиббса
Изотерма адсорбции Гиббса проходит через максимум, соответствующий полному насыщению поверхности. Это объясняется тем, что адсорбцией Гиббс называет избыточную концентрацию в поверхности по отношению к раствору, т.е. разность
СS - CP
где СS – концентрация вещества на поверхности;
СР – концентрация этого вещества в глубине раствора.
Поэтому, когда достигается насыщение поверхностного слоя и CS становится постоянной, разность (СS - CP) при дальнейшем увеличении концентрации раствора начинает падать.
При адсорбции на твердой поверхности (уравнение Фрейндлиха, уравнение Ленгмюра) под адсорбцией подразумевают всю концентрацию вещества на поверхности, т.е. CS . Поэтому при достижении насыщения поверхностного слоя адсорбция становится постоянной.
Выполнение работы.
Основной частью используемого прибора (рис.1) является капилляр 1, конец которого касается поверхности исследуемой жидкости (рис.4), находящейся в сосуде 2. В этом сосуде создается разрежение за счет вытека-
51
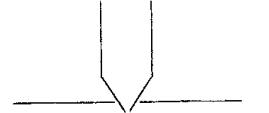
ния воды из аспиратора 4. Скорость вытекания воды регулируется краном 5. При определенном разрежении через жидкость из капилляра проскакивает пузырек воздуха. Скорость проскакивания пузырьков необходимо регулировать так, чтобы время образования пузырьков составило 10–20 с. При такой скорости образования пузырька в жидкости на поверхности пузырька успевает установиться адсорбционное равновесие. Давление воздуха в капилляре измеряют с помощью манометра 3. Давление фиксируют в момент отрыва пузырька. Измерения повторяют 4-5 раз с точностью до одного мм.
Перед началом опыта необходимо аспиратор 4 заполнить водой.
1. Определить постоянную прибора К.
Налить в пробирку 2 дистиллированной воды и опустить в воду капилляр так, чтобы погружение его было минимальным (рис.4).
Рис.4
Наполнить аспиратор водой, а затем, постепенно открывая кран 5 (рис.1), отрегулировать равномерный проскок пузырьков.
Замерить максимальный перепад уровней (h0) в манометре при проскоке пузырька (рис.1). Результат записать.
h0= PH2O
2. Приготовить 8 растворов изобутилового спирта указанных преподавателем концентраций. Концентрация исходного раствора 1н, объем приготавливаемого раствора 50мл. Для расчета необходимого объема исходного спирта пользуются формулой:
С0V0=СV
где С0V0 – нормальность и объем исходного 1н раствора спирта; СV – нормальность и объем приготавливаемого раствора спирта.
3. Определить максимальный перепад уровней (h) в манометре при проскоке пузырька через приготовленные растворы, начиная измерения с раствора меньшей концентрации и переходя к растворам с большей концентрацией. Очень важно при переходе от одного раствора к следующему
52

вначале ополаскивать пробирку исследуемым раствором, а затем наливать свежую порцию для определения h. Не менее важно следить, чтобы раствор не попал в отросток пробирки и соединительную резину.
Для проведения опыта необходимый объем приготовленного раствора перенести из колбы в сосуд 2 и измерить по манометру максимальное давление Р, при котором отрывается пузырек. Давление Р будет равно h – максимальному перепаду уровней: h=Рспирта. Полученные данные записать в табл.2.
Обработка результатов эксперимента.
1. По формуле σ = K P определить постоянную прибора
K = σH 2O .
PH 2O
Поверхностное натяжение воды приведено в табл.1.
|
Поверхностное натяжение воды на границе с воздухом |
Таблица 1 |
||||
|
|
|||||
|
15о |
18о |
20о |
22о |
|
25о |
σ ·103 |
73,49 |
73,03 |
72,75 |
72,44 |
|
71,97 |
2. По формуле σ=КР рассчитать поверхностное натяжение каждого из восьми приготовленных растворов спирта. Полученные данные записать в табл.2.
Таблица 2
С (кмоль/м3) |
Р (мм.рт.ст.) |
σ; Н/м |
|
|
|
3. По полученным данным построить график зависимости поверхностного натяжения от концентрации σ=f(c).
4. Рассчитать адсорбцию на границе раствор – воздух.
Для этого графически определить величину отрезка АD для каждой из 8 концентраций спирта, как показано на рис.2. Затем по формуле (7) рассчитать адсорбцию Г для каждого раствора.
Полученные данные занести в табл.3.
|
|
|
|
|
|
Таблица 3 |
|
С , моль/л или |
AD = −C |
dσ н/м |
Г = |
AD |
, моль/м |
2 |
|
кмоль/м3 |
dC |
|
RT |
|
|||
|
|
|
|
|
|
|
|
5. По полученным данным (табл.3) построить изотерму адсорбции
Г=f(С).
53
