
- •Лабораторная работа №1 кинетика физико-химических процессов. Химическое равновесие
- •Экспериментальная часть
- •1.1. Ход и данные опыта
- •1.2. Расчет и анализ данных, или анализ результатов наблюдений
- •1.3. Вывод
- •2.1. Ход и данные опыта
- •2.2. Расчет и анализ данных, или анализ результатов наблюдений
- •2.3. Вывод
- •4.2. Расчет и анализ данных, или анализ результатов наблюдений
- •4.3. Вывод
- •5.1.Ход и данные опыта
- •5.2. Расчет и анализ данных, или анализ результатов наблюдений
- •5.3. Вывод
- •6.1. Контрольные вопросы
- •Литература
- •Лабораторная работа №1 Тема: Кинетика физико-химических процессов. Химическое равновесие.
4.3. Вывод
Результаты опыта подтверждают принцип Ле Шателье: большое количество исходных веществ/продуктов реакции сместило равновесие в сторону продуктов реакции/исходных веществ, чем уменьшило воздействие большего количества исходных веществ/продуктов реакции.
5. Название опыта: Влияние температуры на состояние равновесия
5.1.Ход и данные опыта
Условие проведения опыта: При взаимодействии йода с крахмалом образуется вещество сложного состава – йодокрахмал, синего цвета. Реакцию можно представить в виде
![]()
![]() .
.
Изменение интенсивности синего окрашивания иодокрахмала позволяет следить за сдвигом химического равновесия при изменении температуры.
Порядок выполнения опыта: В пробирку нальем 4 –5 мл раствора крахмала и добавим несколько капель 0,1 н раствораI2до появления синего окрашивания. Разделим содержимое пробирки на две. Нагреем одну пробирку с раствором, поместив её в стакан с горячей водой. Затем охладите её до комнатной температуры (под проточной водой), наблюдая в обоих случаях за изменением окраски растворов и сравнивая её с контрольной.
5.2. Расчет и анализ данных, или анализ результатов наблюдений
При повышении температуры цвет раствора в пробирке светлеет, а при уменьшении становиться ярко-синий (голубой) относительно контрольной пробирке.
При изменении температуры изменяется как прямая, так и обратная реакция, но в разной степени.
Для определения направления смещения равновесия необходимо определить тепловой эффект процесса.
![]()
Если
энергия активации прямой реакции больше
энергии активации обратной, что характерна
для эндотермической реакции (![]() ),
то с увеличением температуры скорость
прямой реакции увеличивается больше
чем скорость обратной (
),
то с увеличением температуры скорость
прямой реакции увеличивается больше
чем скорость обратной (![]() следствие из уравнения Аррениуса).
Следовательно, повышение температуры
увеличивает константу равновесия
эндотермической реакции, т.к. увеличивается
отношение
следствие из уравнения Аррениуса).
Следовательно, повышение температуры
увеличивает константу равновесия
эндотермической реакции, т.к. увеличивается
отношение![]() .
.
В
нашем случае энергия активации прямой
реакции, меньше энергии активации
обратной, т.е. реакция экзотермическая
(![]() ).
С увеличением температуры скорость
обратной реакции увеличивается больше,
чем скорость прямой (
).
С увеличением температуры скорость
обратной реакции увеличивается больше,
чем скорость прямой (![]() ).
Следовательно, повышение температуры
уменьшает константу равновесия
экзотермической реакции, т.к. отношение
).
Следовательно, повышение температуры
уменьшает константу равновесия
экзотермической реакции, т.к. отношение![]() .
.
5.3. Вывод
Установлено,
что при
![]() равновесие смещается в сторону
эндотермической реакции(
равновесие смещается в сторону
эндотермической реакции(![]() ),
а при
),
а при![]() в сторону экзотермической (
в сторону экзотермической (![]()
![]() )
)
1. Запишите выражение ЗДМ для реакций:
а) 2S(к) + 2H2O(г) → O2(г) + 2H2S(г); б) 2NOCl(г) → 2NO(г) + Сl2(г).
6.1. Контрольные вопросы
1. Запишите выражение ЗДМ для реакций:
а) 2S(к) + 2H2O(г) → O2(г) + 2H2S(г); б) 2NOCl(г) → 2NO(г) + Сl2(г).
Как изменится их скорость, если: для реакции «а» увеличить объем в 2 раза, для реакции «б» повысить температуру на 20К (γ=5)? Ответ подтвердите расчетами.
а) 2S(к) + 2H2O(г) → O2(г) + 2H2S(г)
ЗДМ
для данной реакции: ![]()
При
увеличении объема в 2 раза давление
уменьшится в два раза (по закону
Бойля-Мариотта), следовательно, и
концентрация уменьшится в 2 раза:
![]()
Скорость реакции уменьшится в четыре раза.
б) 2NOCl(г) → 2NO(г) + Сl2(г)
ЗДМ
для данной реакции: ![]()
Зависимость
скорости химической реакции от температуры
определяет правило Вант-Гоффа, которым
мы воспользуемся при решении задачи:
скорость большинства химических реакций
при повышении температуры на каждые 10
градусов возрастает в 2-4 раза. Математически
это выражается формулой: 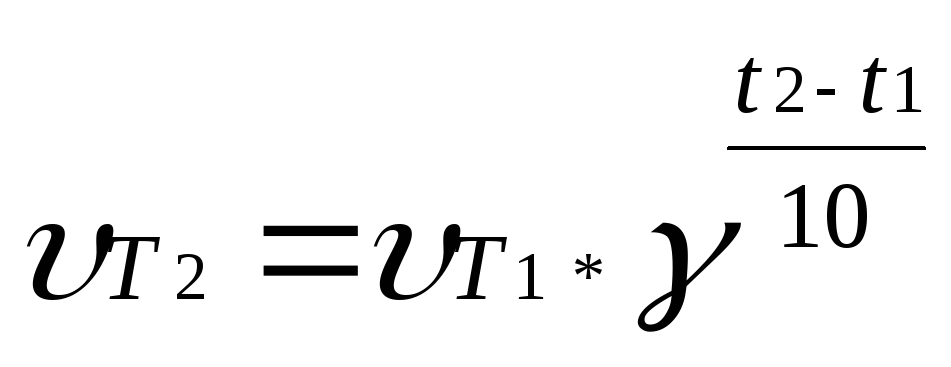
Для
нашей задачи: ![]()
Скорость реакции увеличится в двадцать пять раз.
2.
Для реакции ![]() константа скорости при 288 К равна
константа скорости при 288 К равна
![]() л/(моль·мин),
а при 298 К -
л/(моль·мин),
а при 298 К -![]() л/(моль·мин). Вычислите энергию активации
этой реакции и проверьте для данного
примера на основании соответствующих
расчетов применимость правила Вант-Гоффа.
л/(моль·мин). Вычислите энергию активации
этой реакции и проверьте для данного
примера на основании соответствующих
расчетов применимость правила Вант-Гоффа.

Правило Вант-Гоффа для данной задачи:
![]()
3.
Константа равновесия реакции ![]() при
температуре 927 °С равна 0,74. Рассчитайте
значение Kc
этой реакции при 727 °С, если равновесные
концентрации веществ равны (моль/л):
0,04 (СО); 0,64 (H2O);
0,16 (CO2);
0,16 (H2),
и установите направление смещения
равновесия в системе при понижении
температуры. Какая это реакция экзо-
или эндотермическая? Как повлияет
повышение давления в системе на смещение
равновесия и численное значение константы
равновесия данной реакции?
при
температуре 927 °С равна 0,74. Рассчитайте
значение Kc
этой реакции при 727 °С, если равновесные
концентрации веществ равны (моль/л):
0,04 (СО); 0,64 (H2O);
0,16 (CO2);
0,16 (H2),
и установите направление смещения
равновесия в системе при понижении
температуры. Какая это реакция экзо-
или эндотермическая? Как повлияет
повышение давления в системе на смещение
равновесия и численное значение константы
равновесия данной реакции?

