
sobchuk
.pdf23. Фотобиологические процессы.
К фотобиологическим относят процессы, начинающиеся с поглощения кванта света и заканчивающиеся какой-либо физиологической реакицей. К таким процессам относятся: фотосинтез,фотаксис, фототропизм, зрение, действие УФ лучей, хемилюминисценция.
Условно всякий фотобиологический процесс можно разбить на несколько стадий:
1.поглощение кванта света
2.внутримолекулярные процессы размена энергией
3.межмолекулярные процессы переноса энергии возбужденного состояния
4.первичный фотохимический акт
5.темновые реакции
6.биохимические реакции
Хемилюминисценция – свечение, сопровожлающее химические реакции. Наличие такого свечения означает, что энергия, которая выделяется на одной из стадий химического процесса протекающего в системе, оказывается достаточной для образования одного из продуктов реакции в электронно-возбужденном состоянии.
24. Пламенная фотометрия.
Используется для определения электролитов и других элементов, атомы которых способны возбуждаться и испускать свечение в высокотемператрном пламени газовой горелки.
Образец растворяют в воде и с помощью распыления вводят в пламя горелки, в случае высокой температуры пламени внешние электроны атомов исследуемого вещества захватывают часть тепловой энергии и переходят на более высокий энергетический уровень. Поглощаемая ими энергия выделяется в виде квантов световой энергии. Длина волны испускаемого света зависит от структуры, электронной оболочки атома и отражает химическую структуру элемента. При разложении света пламенем, в котором находятся возбуждающие атомы веществ мы получим линейчатый спектр. По интенсивности свечения основной, называемой характеристической, линии можно судить о количественном содержании элемента в жидкости.
Основными ограничениями в исследовании является сравнительно низкая температура пламени, наличие безизлучательных переходов.
Для получения тепла можно использовать различные тепловые газы, но лучше всего использовать ацетилен или водород, подаваемые в нужную зону вместе с килородом.
Пламенная фотометрия осуществляется с использованием специальных приборов
– пламенных фотометров. Можно анализировать до 50 элементов, характеристические линии четко отделены друг от друга.
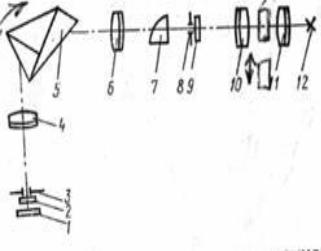
25. Универсальный монохроматор, калибровка, измерения
Принцип работы универсального монохроматора основан на разложении светового потока прошедшего через кювету с исследуемым веществом или раствором, в спектр при помощи призмы. Световой поток от электрической лампочки 12 направляется на"конденсор с диафрагмой . Параллельный пучок светового потока проходит поочередно через кювету с раствором и кювету с растворителем. Далее пучок светового потока собирается конденсором 10 на входную щель 8, защищенную стеклом 9. Изображение входной щели проектируется объективом коллиматора 6 на призму 5, которая разлагает световой поток в спектр и изменяет его направление на 90°. Объективом камеры 4 спектр проектируется на выходную щель 3, вырезающую монохроматический участок.
Монохроматический световой поток проходит через защитное стекло выходной щели 2 и попадает на фотоэлемент с запирающим слоем 1. Фотоэлемент связан с зеркальным гальванометром отсчетного приспособления. Неподвижная прозрачная шкала, освещаемая с одной стороны лампочкой, отражается зеркальцем
гальванометра через |
ряд увеличительных |
линз на матовое |
стекло, где и |
производится |
отсчет. |
Отсчетное |
приспособление |
содержит |
три шкалы: |
миллиметровую и две логарифмические.
При использовании монохроматора важно, чтобы устройство отсчета длины волны показывало точно длину волны падающей на фотоэлемент. Для калибровки таких приборов используют спектр излучения ртути в газообразном состоянии. Для градуировки ртутную лампу устанавливают вместо источника, а на место выходной щели – тубу с окуляром на котором выставлена спектральная длина ртути в виде индекса. В поле зрения окуляра имеется индекс, относительно которого устанавливается спектральная линия спектра излучения ртути. Вращением барабана длин волн устанавливают определенную спектральную линию против индекса и в таблицу записывают длину волны линии ртути и отсчет по барабану длин волн. После того как закончено составление таблицы по всем спектральным линиям, для которых указаны длины волн, трубу с окуляром заменяют выходной щелью, за которой помещается фотоэлемент. Барабан длин волн устанавливают на линию ртути № 16 с =435,84 нм, ширина выходной щели должна быть 0,01 мм. Медленным вращением барабана в сторону меньших длин волн добиваются максимального показания миллиметровой шкалы отсчетного приспособления. Операцию повторяют несколько раз, каждый раз отмечая показание шкалы длин волн. Если наблюдается расхождение с отсчетом по индексу окуляра, то вводится постоянная положительная или отрицательная поправка по шкале на все отсчеты для линий ртути.
26. Виды электрофореза. ВВ электрофорез.
Существует множество разновидностей и модификаций данного метода:
*Электрофорез в свободных средах (без поддерживающей среды) o Электрофорез с подвижной границей
o Зональный электрофорез без поддерживающей среды
*Капиллярный электрофорез
*Зональный электрофорез в поддерживающей среде с капиллярной структурой o Электрофорез на фильтровальной бумаге
o Электрофорез белков на ацетат-целлюлозной мембране
o Электрофорез в колонках и блоках гранулированной поддерживающей
среды
o Электрофорез белков в ПААГ
o Электрофроез белков в крахмальном геле o Электрофорез белков в агарозном геле
Электрофорез с использованием среды носителя:
При этом методе используют образцы только небольших размеров. Природа среды носителя (например, бумага, ацетат целлюлозы, гель крахмала, агаровый гелъ, полиметакриламид, смешанный гель) обусловливает дополнительные факторы, влияющие на подвижность. Скорость перемещения зависит от подвижности частиц, а также от электро-эндосмо-тического тока (в случае носителей с полярными свойствами), от токов, обусловленных испарением (вызванным теплом, генерируемым за счет эффекта Джоуля), и от градиента электрического поля.
Составные части прибора для электрофореза на среде-носителе: Источник постоянного тока, предпочтительно со стабилизированным напряжением. Камера для электрофореза, обычно в форме параллелепипеда, выполненная из стекла или прочного пластического материала, с плотной воздухонепроницаемой крышкой, обеспечивающей поддержание атмосферы насыщенной влажности. В противоположные стенки камеры запаяны два изолированных проводника, на конце каждого из них имеется внутренний соединитель, к которому присоединены электроды из платиновой проволоки. В целях безопасности камера должна быть снабжена приспособлением, обеспечивающим прерывание электропитания при снятии крышки. В камере у двух противоположных сторон вставлены две двойные кюветы, разделенные вдоль на две равные половины. Вдоль основания каждого из внешних отделений кювет проложен один платиновый электрод. Электроды соединены через наружный изолированный кабель с источником постоянного тока напряжением не менее 450 В при 150 мА. Источник энергии должен быть оборудован прибором, контролирующим и указывающим напряжение, а также потребление тока. Для стабилизации напряжения может быть встроена дополнительная цепь. Держатель. Если используют бумагу или ацетат целлюлозы, полоски носителя, пропитанные проводящей жидкостью, укрепляют с помощью соответствующего приспособления в определенном положении, а их концы погружают в кюветы с электродами. При электрофорезе на геле ровный слой геля помещают клеющей стороной на стекло и к каждому концу слоя присоединяют электрические клеммы.
Электрофорез в гелях – метод, который служит для разделения макромолекул на основе их размера, электрического заряда и других физических свойств. Движущей силой электрофореза является напряжение, прикладываемое к электродам на каждом конце геля. Свойства молекул определяют, насколько быстро электрическое поле может перемещать их через желеобразную среду. Много биологических молекул обладают ионизируемыми группами, и при любом заданном рН, существуют в растворе как электрически заряженные частицы. В зависимости от природы заряда среды, заряженные частицы будут мигрировать либо к катоду, либо к аноду. Электрофорез в агарозном геле является стандартным методом, используемым для разделения, идентификации и очистки фрагментов ДНК. Гель агара обладает меньшими оберационными свойствами чем хроматографическая бумага, это создает лучшие возможности для передвижения и фракционирования.
Имунофорез – комбинация электрофаритического и имунологического фракционирования белков.
Ракетный электрофорез : используют гель, который содержит антитела. Вдоль кромки слоя геля делают ряд лунок, куда помещают исследуемый материал. После этого проводят электрофорез. При воздействии электрического поля антиген входит в гель, происходит движение антигенов и антител. Антигены движутся быстрее, чем антитела. В результате движения в одном направлении образуется осадок ракетообразной формы.
27. Виды электрофореза. НВ электрофорез.
Существует множество разновидностей и модификаций данного метода:
*Электрофорез в свободных средах (без поддерживающей среды) o Электрофорез с подвижной границей
o Зональный электрофорез без поддерживающей среды
*Капиллярный электрофорез
*Зональный электрофорез в поддерживающей среде с капиллярной структурой o Электрофорез на фильтровальной бумаге
o Электрофорез белков на ацетат-целлюлозной мембране
o Электрофорез в колонках и блоках гранулированной поддерживающей
среды
o Электрофорез белков в ПААГ
o Электрофроез белков в крахмальном геле o Электрофорез белков в агарозном геле
Капилярный электрофорез: капиляры заполняют буферными растворами, к концам капиляров подается напряжение до 30 кВ. Сам кварц имеет положительно заряженные группы атомов. В капиляре наблюдаются поляризация электролита: вблизи стенок больше отрицательное поле, в центре – положительное. Под влиянием поля в капиляре создается электроосмотический поток, который направлен к минусу. Этим потоком перемещаются компоненты смеси. В зависимости от природы вещества, величины заряда скорость их движения различна, поэтому происходит фракционирование смеси. В одной из точек капилляра, ближе к концу, устанавливают оптический детектор с помощью которого определяют концентрацию разделенных компонентов. Получается электрофуриграмма – последовательность пиков по которым можно идентифицировать соединения и определить их количество.
Достоиства: высокая эфективность разделения, не тербуются прецезионные приборы.
28. Хроматография и ее разновидности (классификация, методы).
Существует много видов хроматографии. В основе этих методов лежат различные распределения составных частей исходной смеси между двумя фазами: подвижной и неподвижной. Процесс разделения складывается из многократных актов перехода вещества из одной фазы в другую. Хроматографическое разделение – процесс при котором компоненты разделяемой смеси многократно распределяются между двумя несмешивающимися фазами: неподвижной и подвижной. Разделение веществ происходит либо за счет их способности связываться с поверхностью сорбентов, либо за счет распределения между неподвижной фазой, которая может быть твердой или жидкой, и подвижной фазой — жидкой или газовой, либо за счет способности вещества образовывать гетерополярные связи с сорбентами, которые содержат ионы с зарядом, противоположным по знаку заряду иона анализируемого вещества. В зависимости от особенностей физического состояния применяемых фаз различают газожидкостную хроматографию, газоадсорбционную, жидклстножидкостную хроматографию и жидкостноадсорбционную.
Кновым методам относится хроматография в тонких слоях. Этот метод включает
всебя элементы как распределительной, так и адсорбционной хроматографии.
По виду взаимодействия исследуемого вещества с фазами хроматография может быть: абсорбционная, ионообменная, распределительная, гельхроматография, афинная хроматография – биоспецифическая хроматография.
Абсорбционная: разделение на фракции основано на различной сорбированности веществ на одной и той же фазе. Процесс зависит от свойств адсорбентов, соединений и растворителей. Может иметь физический и химический характер.
Воснове ионной хроматографии способность некоторых твердых веществ (ионообмеников) обмениваться ионами при контакте с определенным электролитическим раствором. Ионообменная хроматография используется для разделения органических и неорганических соединений, способ-ных к диссоциации.
Воснове распределительной хроматографии лежит различная растворимость веществ в двух несмешивающихся фазах. На неподвижную фазу наносят вещество и пропускают поток растворителя. Чем лучше данное вещество растворимо в подвижной фазе, тем дальше оно продвинется по направлению тока раств-рителя по неподвижной фазе. Менее растворимые вещества распределяются ближе к точке нанесения (соответственно своей растворимости). Есть хроматография которая отличается элементом через который осуществляется прохождение исследуемой жидкости: колонка, пластина, бумага и т.д.
Химическая хроматография: распределение осуществляется в результате установления прочной связи между разделяемым веществом и неподвижной фазой, образуется комплексный осадок.
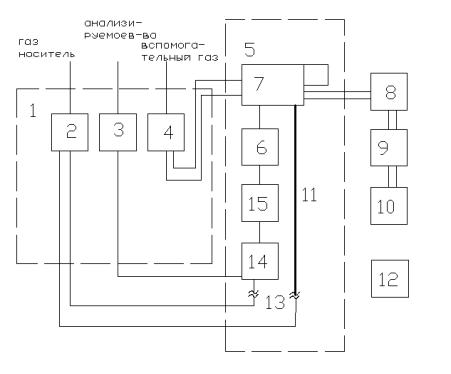
29. Газовый хроматографический анализатор.
Разделение компонентов анализируемой смеси методом газо-вой хроматографии основано на их многократном распределении между двумя различными фазами. Неподвижной фазой служит твердое вещество или жидкость, а подвижной всегда является газ. Если неподвижная фаза — твердое вещество (тип хроматографии «газ
— твердое вещество»), разделение компонентов смеси про-исходит за счет их различной способности связываться с адсор-бентом. Если неподвижной фазой служит нелетучая жидкость (тип хроматографии «газ — жидкость»), компоненты анализируемой смеси разделяются за счет их различной растворимости в неподвижной фазе.
1 – блок подготовки в-ва
2- узел очистки газа носителя 3- узел очистки анализир-го в-ва
4- узел очистки вспомогат-го газа
5- аналитической устройство
6- хроматогр-я колонка
7- диференциальный детектор
8 – измерительный преобраз-ль
9- вычислительное устройство
10регистратор
11- хроматограф-я трубка
12 – блок управления
13подогреватель
14дозатор
15 – испаритель
Хроматограф – устройство циклического действия с 2 режимами работы: подготовка и анализ. В обоих режимах подводится газ носитель и вспомогательный газ. В режиме подготовки газ носитель прокачивается по обоим каналам аналитического устройства. В какое-то время через дозатор и испаритель происходит отбор пробы анализируемого вещества, затем дозатор переключается в режим анализа. По обоим каналам проходит газ носитель и проба транспортируется в хроматографической колонке, где происходит разделение пробы на фракции. Фракции продвигаются к концу трубки, где стоит детектор фиксирующий физико- хим-е свойства. Детектор непрерывно анализирует физико-хим-е свойство потока, на его выходе формируется сигнал.
Оценка концентрации может определяться по пику или по площади сигнала.
При поступлении в измерительную камеру детектора какого-то компонента сигнал с детектора меняется в заивисимости от концентрации и его физико-хим-х свойств. Сигнал на выходе детектора: ∆Ui(η)= Ui(η)-Uo=k(Пi-Пp-n)αi(η)
Ui(η) – текущее значение сигнала на выходе k- коэф-т преобразования детектора
Пi- физико-химическое свойство компонента
Пp-n- физико-хим-е свойство газа носителя к кот-му чувствителен детектор αi – концентрация i-го компонента
Последовательность сигналов с детектора образует хроматограмму и каждому компоненту будет соответсвоватьвремя прохождения хроматографической колонки
– время удерживания: |
= |
|
|
|
|||
|
|
L- длина хроматографической колонки
Wi – скорость движения компонента по хроматографической колонке
Wi=Ri∙Wг.н.
Wг.н. – скорость движения газа носителя
Ri- коэф-т удерживания – доля от общего количества веществ находящихся в подвижной фазе. Зависит от соотношения между подвижной и неподвижной фазами, молекулярной массы, температур, давления газа. Характеризует сорбируемость компонента на данной подвижной фазе.
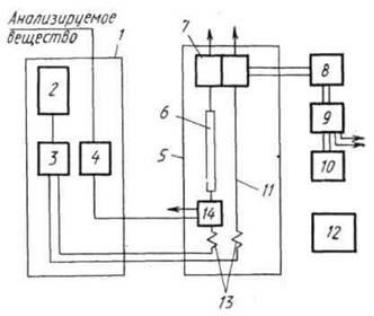
30.Жидкостной хроматографический анализатор.
Использование жидкостной хроматографии для анализа состава жидких многокомпонентных веществ имеет ряд преимуществ по сравнению с газовой при решении аналитических задач. Наиболее важные из них — отсутствие необходимости нагревания основных узлов хроматографа до высоких температур с целью предот-вращения конденсации паров анализируемой жидкости; отсутствие деструкции высокомолекулярных жидких веществ; во многих случаях большая скорость анализа и эффективность разделения.
1- блок подготовки анализ-го в-ва 2- резервуар для жидкости 3- насос высокого давления
4- узел стабилизации параметров
5- аналитическое устройство
6- хроматограф-я колонка
7- диференциальный детектор
8-измерительный преобразователь
9-вычислительное устройство
10-регистраторы
11-хроматограф-я трубка
12блок управления
Последовательность работы жидкостного хроматографа идентична последовательности работы газового
хроматографа. Аналогична работа всех остальных блоков и элементов.
Вэтих хроматографах обычно используются дозаторы золотникового типа и прямые колонки длиной до 1 м, заполненные сорбентом со средним диаметром фракций 5—50 мкм. В качестве детекторов в жидкостных хроматографах чаще других используют детекторы, основанные на поглощении электромагнитного излучения в ультрафиолетовой области (185—2500 нм) и рефрактометрические детекторы. По принципу действия они аналогичны ультрафиолетовым адсорбционным анализаторам и рефрактометрам. Отличие детекторов от названных анализаторов состоит в том, что кюветы детекторов имеют обычно меньший объем, который не превышает 10-2 см3.
Внекоторых случаях в жидкостных хроматографах используются кондуктометрические, диэлькометрические детекторы, детекторы теплоты сорбции. Принципы действия этих устройств аналогичны принципам работы соответствующих анализаторов.
Недостаток – насос понжерного типа.
Что бы не было колебаний жидкости применяют демфер.
