
- •Ароматические амины
- •Номенклатура ароматических аминов
- •Изомерия ароматических аминов
- •4. Реакция Гофмана
- •Электронное строение ароматических аминов
- •Химические свойства ароматических аминов
- •1. Кислотно-основные свойства аминов
- •1) Основные свойства аминов
- •2. Реакции аминов как нуклеофильных реагентов
- •1. Алкилирование ароматических аминов
- •2. Ацилирование ароматических аминов
- •3. Реакции с альдегидами и кетонами
- •5. Окисление ароматических аминов
- •3. Реакции электрофильного замещения в бензольном кольце
- •1. Реакция галогенирования
- •2. Реакция сульфирования
2. Реакции аминов как нуклеофильных реагентов
Хотя нуклеофильные свойства у ароматических аминов выражена слабее, чем у алифатических (за счет сопряжения свободной электронной пары с бензольным кольцом), для них характерны реакции алкилирования и ацилирования, взаимодействие с альдегидами и кетонами, реакции с азотистой кислотой.
1. Алкилирование ароматических аминов
Атомы водорода в аминогруппе ароматических аминов могут быть замещены на алкильные радикалы. В качестве алкилирующих агентов используют галогеналканы, спирты, диалкилсульфаты.
Реакция алкилирования приводит к получению вторичных и третичных аминов.
Реакция протекает по механизму нуклеофильного замещения (SN). В качестве нуклеофила выступает молекула ароматического амина, которая за счет свободной электронной пары атома азота атакует атом углерода с частичным положительным зарядом (δ+).
В зависимости от строения галогеналкана (спирта) может реализовываться SN1 или SN2 механизм:
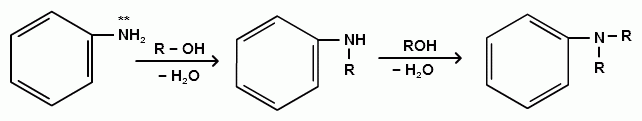
Ди- и трифениламины – плохие нуклеофилы, поэтому реакции алкилирования происходят с ними с трудом.
2. Ацилирование ароматических аминов
Атомы водорода в аминогруппе первичных и вторичных аминов могут быть замещены на ацильные радикалы (RCO-).
Ароматические амины ацилируются не только ангидридами и хлорангидридами карбоновых кислот, но и карбоновыми кислотами.
В результате реакции ароматические амины превращаются в амиды соответствующих карбоновых кислот.
Ацильные производные анилина называют анилидами.
Реакция протекает по механизму нуклеофильного замещения (SN).
Нуклеофилом является ароматический амин, который атакует карбонильный атом углерода с частичным положительным зарядом (δ+).

Реакция ацилирования имеет большое значение. Она используется для защиты аминогруппы от нежелательных воздействий, для уменьшения ориентирующего влияния аминогруппы при проведении некоторых реакций.
Амиды карбоновых кислот могут легко гидролизоваться как в кислой, так и в щелочной среде, поэтому после проведения необходимых реакций ацильная «защита» легко снимается и образуется свободная аминогруппа.
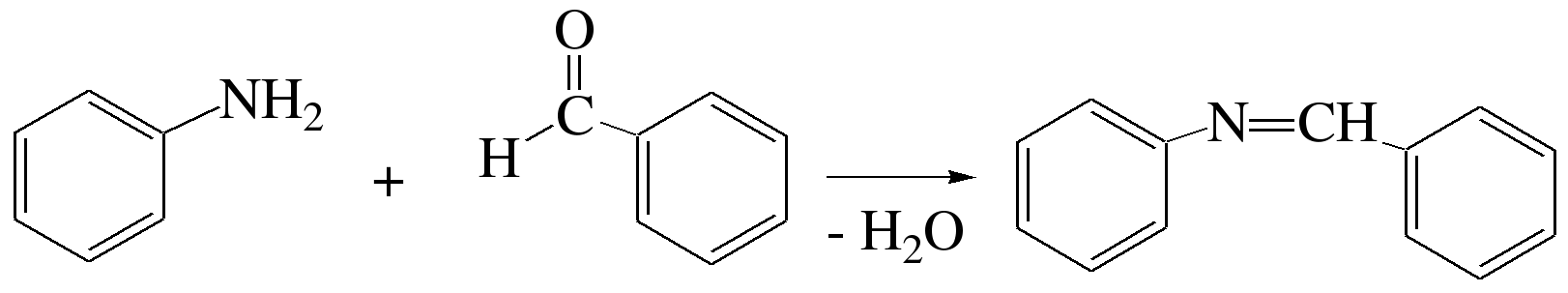
3. Реакции с альдегидами и кетонами
Первичные ароматические амины легко вступают в реакции с ароматическими альдегидами и кетонами с образованием азометинов (основания Шиффа).
При их образовании в качестве нуклеофила выступает ароматический амин.
Первая стадия – реакция нуклеофильного присоединения по карбонильной группе (АN), на второй стадии следует отщепление молекулы воды:

Шиффовы основания легко гидролизуются в кислой среде с образованием исходных веществ (анилина и бензальдегида):

Простейшие шиффовы основания бесцветны, более сложные окрашены и относятся к классу азометиновых красителей.
Для крашения тканей эти красителе не нашли широкого применения в связи с легкостью гидролиза связи C=N в кислой среде.
Однако они широко используются в цветной фотографии, для крашения пластмасс и в полиграфии.
4. Реакции аминов с азотистой кислотой Первичные ароматические амины с азотистой кислотой при 0 – 5°С образуют соли диазония:

хлорид фенилдиазония
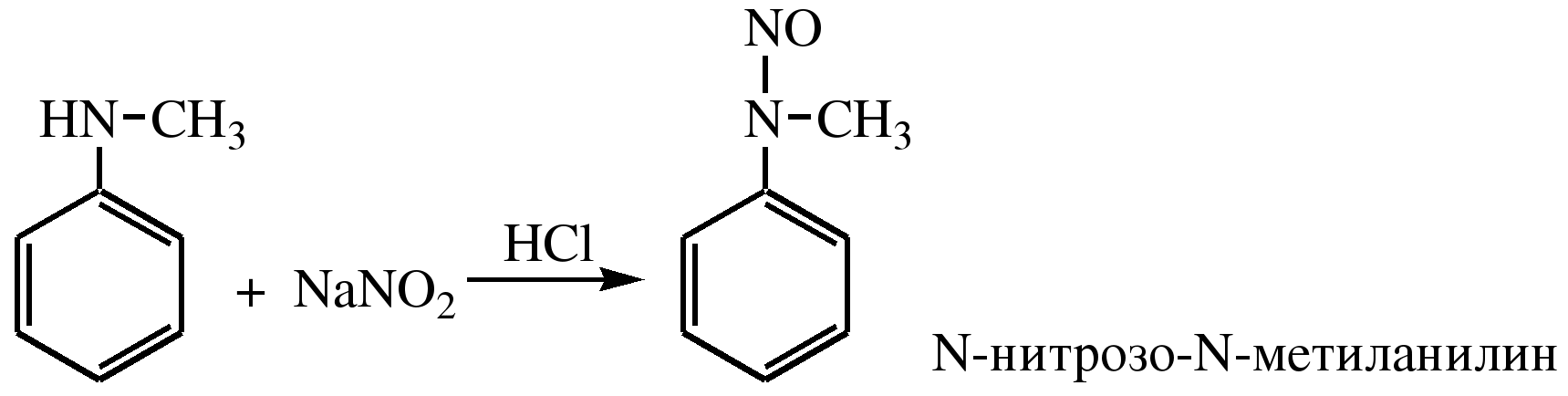
Вторичные амины при взаимодействии с азотистой кислотой образуют N-нитрозо-N-метиланилины:
Третичные амины с азотистой кислотой вступают в реакцию электрофильного замещения:

