
- •Введение в обмен веществ
- •Основные особенности разных фаз метаболизма
- •Глава I. Энергетический обмен
- •1.1. Свободная энергия и законы термодинамики
- •1.1. Макроэргические соединения
- •Стандартная свободная энергия гидролиза органических фосфатов
- •1.1.2. Пути синтеза атф и его роль
- •1.1.3. Окислительно – восстановительное равновесие, окислительно –восстановительный потенциал
- •Стандартные потенциалы некоторых окислительно- восстановительных систем
- •1.2. Биологическое окисление
- •1.2.1. Характеристика биологического окисления
- •Строение комплексов полиферментного ансамбля дыхательной цепи митохондрий
- •1.2.2. Сопряжение биологического окисления и окислительного фосфорилирования
- •1.2.3. Регуляция скорости дыхания митохондрий
- •1.2.4. Разобщение дыхания и фосфорилирования
- •Краткая характеристика некоторых ионо(протоно)форов
- •1.2.5. Патология биоэнергетических процессов
- •II. Наследственные и приобретенные дефекты в работе промежуточных переносчиков этц:
- •III. Недостаток кислорода (гипоксия):
- •IV. Наличие разобщителей биологического окисления и фосфорилирования.
- •1.2.6. Механизмы защиты от токсического действия кислорода
- •А) Антиоксиданты ферментативной природы
- •Б) Антиоксиданты неферментативной природы
- •Роль катионов металлов с переменной валентностью в свободно-радикальных реакциях
- •В) Антиоксиданты внеклеточных жидкостей
- •1.3. Микросомальное окисление
- •Глава II
- •2.1.2. Регуляция процесса окисления пирувата
- •2.1.3. Патология декарбоксилирования пирувата
- •2.2. Цикл трикарбоновых кислот
- •2.2.1. Последовательность реакций цтк
- •2.2.2. Энергетическая ценность процесса
- •Образование макроэргических соединений в цтк
- •2.2.3. Участие витаминов в цтк
- •2.2.4. Биологические функции цикла Кребса
- •2.2.5. Регуляция превращений цитрата
Стандартные потенциалы некоторых окислительно- восстановительных систем
|
Система |
Е0,вольт |
|
Сукцинат / 2-оксоглутарат |
- 0,67 |
|
Н+/Н2 |
- 0,42 |
|
НАД+/ НАДН |
- 0,32 |
|
Липоат окисленный / липоат восстановленный |
- 0,29 |
|
Ацетоацетат / β-гидроксибутират |
- 0,27 |
|
Пируват / лактат |
- 0,19 |
|
Оксалоацетат / малат |
- 0,17 |
|
Флавопротеин окисленный / флавопротеин восстановленный |
- 0,12 |
|
Фумарат/ сукцинат |
+ 0,03 |
|
Цитохром b-Fe3+/ цитохромb-Fe2+ |
+ 0,08 |
|
Убихинон окисленный / убихинон восстановленный |
+ 0,10 |
|
Цитохром c-Fe3+/ цитохромc-Fe2+ * |
+ 0,22 |
|
Цитохром a-Fe3+ / цитохром a-Fe2+ |
+ 0,29 |
|
Кислород / вода |
+ 0,82 |
1.2. Биологическое окисление
Наиболее полное высвобождение энергии происходит при распаде органических соединений до Н2О и СО2. Причем установлено, что атомы кислорода в углекислом газе берутся из органических веществ, а весь потребляемый организмом кислород включается в молекулы Н2О. Реакция взаимодействия водорода с кислородом относится к экзэргоническим и протекает с одномоментным выделением большого количества энергии. Следовательно, чтобы живые клетки могли использовать эту возможность, не опасаясь за последствия, они должны растянуть во времени этот процесс.
Биологическое окисление - транспорт протонов и электронов от окисляемого субстрата через ряд промежуточных переносчиков на кислород с последующим образованием воды и высвобождением энергии.
1.2.1. Характеристика биологического окисления
Этот процесс осуществляется сложным полиферментным ансамблем, локализованным во внутренней мембране митохондрий и включающим пять комплексов: НАДН-убихинон-редуктазу (Комплекс I), сукцинат-убихинон-редуктазу (Комплекс II), убихинон-цитохром-с-редуктазу (Комплекс Ш), цитохром с-оксидазу (Комплекс IV) и F0-F1 АТФ-синтазу (Комплекс V) (рис. 5).
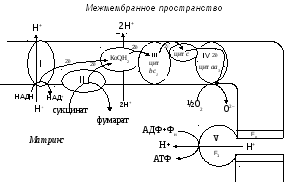
Рис. 3. Схема дыхательной цепи митохондрий (КоQ – убихинон,
цит с – цитохром с)
Окислительно-восстановительные реакции, катализируемые Комплексами I, II, сопряжены с трансмембранным переносом протонов из матрикса митохондрий в межмембранное пространство. Разность электрохимического потенциала ∆μН+ возникает вследствие накопления протонов в межмембранном пространстве, а в матриксе митохондрий – электронов.
Комплекс I: НАДН-убихинон-редуктаза – сложный флавопротеиновый комплекс, в состав которого входят более 25 полипептидных цепей. НАДН-связывающий центр этого комплекса ориентирован в матрикс, что позволяет ему взаимодействовать с восстановленными дегидрогеназами цикла трикарбоновых кислот и ряда других процессов.
Таблица 4
Строение комплексов полиферментного ансамбля дыхательной цепи митохондрий
|
Название |
Локализация, состав, функции |
Редокс–центры |
|
Комплекс I (НАДН – убихинон-редуктаза) |
Трансмембранный комплекс из 25 субъединиц. Предназначен для окисления молекул НАДН, продуцируемых растворимыми матриксными дегидрогеназами. |
1 ФМН 4 FeS-белка
|
|
Комплекс II (сукцинат-убихинон–редуктаза) |
Состоит из серии субъединиц, внедренных во внутреннюю мембрану со стороны матрикса; переносит 2ē и 2Н+ от сукцината на мобильный убихинон липидного бислоя. |
1 ФАД 3 FeS-белка 1 гем b |
|
Комплекс III (цитохром bc1; убихинон–цитохром–с–редуктаза) |
Трансмембранный белок из 11 субъединиц, включает цитохромы b, c1 и FeS-белок. Они образуют цепочку поочередного транспорта каждого электрона от КоQ·Н2 на цитохром с, примыкающего к мембране. |
3 гем b 1 FeS-белок
|
|
Комплекс IV (цитохромоксидаза) |
Ансамбль из 6 субъединиц. Из них каталитическая содержит не только два гема, но и ионы меди (Сu2+В, Сu2+А), она обеспечивает поток электронов от цитохрома c снаружи мембраны на молекулу кислорода в матриксе. |
1 гем а 1 гем а3 1 Сu2+А 1 Сu2+В |
|
F0-F1-АТФ-синтаза |
Сложная молекулярная машина включает два субкомплекса: факторы F0 и F1 (протонтранспортирующая двухсекторная АТФ–аза). |
|
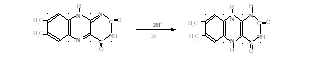
Структура НАД+, установленная Г. Эйлер-Хельпиным с соавторами, представляет динуклеотид, в котором мономеры объединены друг с другом ангидридной связью. Одним мононуклеотидом является АМФ, в другом в качестве азотистого основания выступает амид никотиновой кислоты (рис. 6).

Рис. 6. Строение никотинамидадениндинуклетида (НАД+)
Окисленная форма НАД+ включает в себя катион пиридиния (=N+=), в котором смещается π-электронная плотность сопряженной ароматической системы, делая С4 сильным электрофилом, благодаря этому гидрид ион (Н‾ ) отрывается от субстрата и присоединяется к С4, происходит восстановление. В результате нарушается ароматичность пиридиниевого ядра, следствием чего и является повышение энергии восстановленной формы (НАДН) по сравнению с его окисленной.. Субстрат, лишившись гидрид иона, теряет устойчивость; для стабилизации от него отщепляется протон (рис. 7).

Рис. 7. Схема действия кофермента НАД+
Комплекс I катализирует суммарную реакцию восстановления убихинона (КоQ), сопряженную с трансмембранным переносом протонов (nН+) из матрикса митохондрий в межмембранное пространство:
Н АДН
+ Н+
+ КоQ
+ nН+матр.
НАД+
+ КоQH2
+ nН+межмемб.
АДН
+ Н+
+ КоQ
+ nН+матр.
НАД+
+ КоQH2
+ nН+межмемб.
Р
ФМН
(флавинмононуклеотид)
представляет
собой фосфорилированный
витамин В2
(рибофлавин) (рис. 8), прочно связанный
с апоферментом во внутренней
мембране митохондрий.
Его активным компонентом служит
сопряженная
циклическая структура изоаллоксазина.
Механизм его восстановления
сложен (рис. 9).

Далее электроны и протоны переходят к железосерным центрам Fe-S комплекса I, которые в конечном итоге и передают электроны на убихинон.
Если величина редокс–потенциала окисляемого субстрата выше – 0,32 вольт, тогда роль первичного акцептора выполняет комплекс II: сукцинат-убихинон-редуктаза, содержащая в качестве кофермента ФАД (флавинадениндинуклеотид), который синтезируется в клетке из ФМН путем переноса АМФ от молекулы АТФ. К таким энзимам принадлежат сукцинатдегидрогеназа (окисление янтарной кислоты в цикле Кребса), ацил-КоА-дегидрогеназа (подобное преобразование жирной кислоты в β-окислении), глицерол-1-фосфатдегидрогеназа (распад глицерина), в результате действия которых водород окисляемого субстрата, минуя НАД+, восстанавливает ФАД.
Р
Н
Второй комплекс осуществляет перенос восстановительных эквивалентов от ФАДН2 (кофермент сукцинатдегидрогеназы) через Fe-S центры на убихинон, локализованный в липидном слое внутренней мембраны митохондрий (рис. 10).
Рис. 10. Схема превращения убихинона
Комплекс Ш: убихинон-цитохром–с-редуктаза, называемый также комплексом цитохромов bс1, осуществляет перенос электронов от восстановленного убихинона (КоQH2) на цитохром с. Это сопровождается трансмембранным – переносом протонов из митохондриального матрикса в межмембранное пространство.
Процесс передачи электронов от двухэлектронного переносчика убихинона к одноэлектронным – цитохромомам осуществляется в сложной цепи реакций, названных Q–циклом. В сильно упрощенном виде Q-цикл можно представить следующим образом (рис. 11).
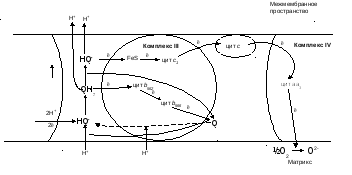
Рис. 10. Схема Q–цикла
Восстановленный в результате работы Комплексов I и II убихинон (КоQH2) диффундирует к наружной стороне внутренней мембраны, отдавая один электрон (через цитохром с1) на восстановление цитохрома с и освобождая в межмембранное пространство два протона. Образующееся при этом промежуточное соединение семихинон-радикал (КоQH•) передает второй электрон цитохрому b, который затем используется на восстановление других молекул КоQ (рис.11).
Несмотря на сложный путь движения электронов в комплексе III, окончательный результат прост: КоQH2 окисляется, а цитохром с - восстанавливается. При этом перенос одного электрона от КоQH2 к данному гемопротеину сопровождается выделением двух протонов (Н+) в пространство между мембранами, поэтому принято считать, что полное окисление одной молекулы КоQH2 протекает с восстановлением двух молекул цитохрома с и переносом четырех протонов из матрикса митохондрий в межмембранное пространство:
К оQH2+2цит
с
(Fе3+)
+ 4Н+матр
КоQ
+ 2цит с
(Fe2+)
+ 4Н+межмемб.
оQH2+2цит
с
(Fе3+)
+ 4Н+матр
КоQ
+ 2цит с
(Fe2+)
+ 4Н+межмемб.
Комплекс IV: цитохромоксидаза катализирует реакцию окисления восстановленного цитохрома с молекулярным кислородом, сопряженную с трансмембранным переносом протонов. Этот сложный олигомерный белок имеет в своем составе два гема (а и а3) и два иона Сu2+, обозначаемые как Сu2+А и Сu2+В. Электрон, полученный от цитохрома с, переносится на Сu2+А. Двигаясь в направлении от цитоплазматической поверхности вглубь мембраны, электрон перемещается от Сu2+А к гему а и далее к гему а3 и Сu2+B – последнему компоненту дыхательной цепи, восстанавливающему О2:
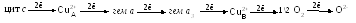
Таким образом, транспорт восстановительных эквивалентов от НАДН к кислороду сопровождается переносом катионов водорода из матрикса в межмембранное пространство (рис. 3), где создается трансмембранный градиент их концентрации: снаружи их в 10 раз больше, чем в матриксе. Возникающий градиент электрохимического потенциала ∆μН+ является движущей силой, стремящейся вернуть протоны обратно, чтобы устранить резкий перепад их величин. Однако возвратное движение ионов Н+ возможно только через специальные трансмембранные каналы (протонтранспортирующая двухсекторная АТФаза – F0-F1-АТФ-синтаза).
