
- •6. В: Объясните механизм образования кефира из молока. Почему белки кефира лучше усваиваются детским организмом?
- •24. В: Почему для всех нозологических форм наследственной патологии дисахаридов характерны диарея, метеоризм? Механизмы их развития
- •75. В: как вы считаете, возникает ли дисбаланс в системе «пол-арз» у больных сд?. Обоснуйте.
- •Первая помощь при отравлении нитратами
Спешл фо 218 (=^_^ =)
За основу взяты старые задачи- 113 штук. Те, которые выбросили из нового списка, просто не буду печатать. Хотя некоторых у меня просто напросто нет. Ответы здесь конечно не айс, но все равно, хоть что-то взять отсюда можно.
-
В: В пептидной цепи между радикалами аминокислот могут возникать химические связи. Выберите пары аминокислот, способные их образовать: а) вал-изолей; б) цис-цис; в) глу-лиз; г) фен-асп. Ответ обоснуйте.
О: а) образуют связь – гидрофобная связь, т.к. обе аминокислоты гидрофобные
б) образуют связь – дисульфидная связь за счет SH
в) образуют связь – ионная связь, т.к. кислая и основная аминокислоты
г) не образуют связи
2. В: Напишите формулу трипептида: лиз-арг-гис. В какой среде находится его ИЭТ? Ответ обоснуйте.
О: ИЭТ – это значение pH, при котором заряд белка стремится к нулю. В этом трипептиде все аминокислоты основные. А значит ИЭТ в щелочной среде.

3: В: Напишите формулу трипептида: глу-асп-ала. Определите его заряд в нейтральной среде. Как изменится заряд в кислой среде? Растворимость? Почему?
О: Глу и асп – кислые аминокислоты, ала – гидрофобная. При рН =7 заряд трипептида отрицательный. В кислой среде ( при добавлении протонов Н+) заряд будет уменьшаться, т.е стремиться к ИЭТ. При уменьшении заряда уменьшается и растворимость.
4. В: Трипептид: вал-лей-ала. Уточните его способность растворяться в воде. Почему?
О: Трипептид образован гидрофобными аминокислотами, между радикалами которых образуются гидрофобные связи. Поэтому в воде не растворяется.
5. В: Два пациента больны дизентерией. У одного величина белкового коэффициента – 0,9, у другого – 1,9. Какова тактика врача в обоих случаях?
О: Дизентерия – это инфекционное заболевание. Обусловленное внедрением в макроорганизм микроорганизма.
БК – это соотношение альбуминов к глобулинам в сыворотке крови. БК= [А]/[Г]=1,5 – 2,3. При внедрении микроорганизма запускается гуморальный иммунитет, что обуславливает выработку гамма-глобулинов. При увеличении глобулинов в крови значение БК уменьшается – значит организм борется с инфекцией- как у первого пациента. Во втором случае БК=1,9, т.е гамма-глобулины не вырабатываются, а значит организм не борется с микроорганизмом. Следовательно, состояние хуже у второго больного. В первом случае – врач назначает антибиотики, которые действуют на мембрану микроба, проникают внутрь клетки, действуют на ДНК микроорганизма, тем самым не позволяя размножаться. Во втором случае назначают иммуностимуляторы- взрослым, а детям и старикам – вводят готовые антитела. Так же и в 1ом и во 2ом случаях дают водно-солевые растворы для предотвращения обезвоживания.
6. В: Объясните механизм образования кефира из молока. Почему белки кефира лучше усваиваются детским организмом?
О: Кефир – продукт кисломолочного брожения, как следствие работы микроорганизмов, продуктами питания которых являются углеводы. Конечный продукт этого процесса – молочная кислота. В молоке лактоза подвергается брожения с образованием молочной кислоты. При этом меняется рН с нейтральной на кислую. Подавляющее большинство белков – кислые, в том числе и белки молока. При изменении рН меняется и заряд белков – он уменьшается, уменьшается также и растворимость. Молочная кислота действует на химические связи между радикалами аминокислот белков молока, рвет эти связи – т.е происходит денатурация ) белки разворачиваются). В кефире белки не осаждаются, а остаются на поверхности. Детьми белки кефира, т.к. они находятся в развернутом виде , усваиваются лучше – т.к. доступны пептидные связи.
7. В: Какие белки плазмы крови альбумины или глобулины быстрее движется при электрофорезе? Почему?
О: Электрофорез – это движение частиц раствора, помещенного в электрическое поле. Скорость движения частиц прямо пропорциональна заряду, и обратно пропорциональна массе частиц. Альбумины и глобулины – кислые белки, значит имеют «-» заряд, но у альбуминов величина этого заряда выше. По массе: альбумины меньше, чем глобулины. Значит по 2м критериям видно, что альбумины при электрофорезе движется быстрее.
8. В: Где в медицине применяют способность белков к денатурации.?
О: Три направления медицины
А) ПРОФИЛАКТИКА: кварцевание, обработка хирургического поля, обработка кожи перед уколом, стерилизация.
Б) ЛЕЧЕНИЕ: химиотерапия – разрушение опухоли, остановка кровотечения – коагуляция (свертывание)
В) ДИАГНОСТИКА: осаждение белков для определения их количества, осаждение для определения количества других веществ в био.жидкостях.
9. В: Что лучше растворяется в воде нуклеиновые кислоты или нуклеопротеиды? Почему?
О:
|
|
НК |
НП |
|
определение |
Это полинуклеотиды, состоящие из мононуклеотидов |
Это сложные белки, простетической группой которых являются нуклеотиды |
|
заряд |
«-» являются полианионами |
При связи с белком-катионом, их отрицательный заряд уменьшается |
При уменьшении заряда, уменьшается и растворимость. Значит лучше растворяются в воде НК.
10. В: Чем опасны неумеренные попытки загореть?
О: При попытке загореть в организме увеличивается синтез меланина. Значит действие УФИ не очень предпочтительно. Если меланина в организме вырабатывается недостаточно, то УФ проникает в более глубокие слои кожи. Таким образом он действует на клетки кожи. А именно на их мембраны. В основе мембран клеток лежит билипидный слой, состоящий из ФЛ, ВЖК. А ВЖК имеют следующий тип строения : -С-С-С-.. т.е. цепь из углеродных атомов. А УФ луч – это сгусток энергии, который рвет эту цепь по гомолитическому типу распада связи, т.е. образуются свободные радикалы, имеющие неспаренный электрон. Именно эти радикалы и запускают ПОЛ. При этом процессе повреждаемся мембрана клетки, и УФ луч проникает внутрь. А внутри клетки с большом количестве находятся белки и НК, которые являются полимерами. При действии на них УФИ – происходит денатурация. Последствия: ожоги, опухоли. Так же при неумеренных попытках загореть провоцируется избыточный синтез витамина D, чо может привести к гипервитаминозу, последствиями чего является увеличения концентрации Са2+ в крови, и он может откладываться в тканях и органах, нарушая их деятельность.
11. : В: У пепсина ИЭТ равна 1. Какие аминокислоты преобладают в его молекуле?
О: Кислые аминокислоты.
12: В: Приходилось ли вам наблюдать за работой ферментов? Приведите примеры.
О: Углеводы: брожение – молочнокислое, спиртовое, лимоннокислое, уксуснокислое и т.д. (йогурты, кефир, квас, квашение капусты, кислое тесто)
Липиды: прогоркание сливочного масла
Белки: гниение (тухлые яйца, испорченные продукты, плесневелый сыр)
13. В: Напишите реакцию декарбоксилирования глутамата. Назовите класс фермента. Роль продукта.
О:

Продукт – гамма-аминомасляная кислота – тормозный медиатор. Фермент- ГЛУТАМАТДЕКАРБОКСИЛАЗА. Класс фермента – лиазы ( рвет –С-С- связь)
14. В: Укажите класс фермента альдолазы гликолиза. Ответ обоснуйте
О: Класс фермента- лиаза. Рвет –С-С- связь. С помощью этого фермента фруктоза-1,6-дифосфат превращается в ГА-3-Ф и ДГАФ.

-
в новых задачах нет!
-
В: Что опаснее ожог кислотой или щелочью (при их равной ионной силе)? Ответ поясните.
О: Опаснее ожог щелочью. И кислота, и щелочь при попадании на кожу вызывают денатурацию белков ткани. Но кислота обладает свойством – гигроскопичности. Это свойство обуславливает захват воды из ткани, т.е при попадании на кожу кислота как бы вытягивает всю воду из ткани и остается сухая корочка. Она и является препятствием для дальнейшего проникновения кислоты в более глубокие слои кожи. Щелочь же таким свойством не обладает и поэтому может вызвать денатурацию белков более глубоких слоев кожи.
-
В: С какой целью кварцуют операционные? Механизм явления.
О: Кварцевание – воздействие УФИ на какую-либо поверхность. Кварцевание используют для обезвреживания микроорганизмов. В основе этого лежит денатурация белков этих микроорганизмов, причем в первую очередь рвутся гидрофобные взаимодействия радикалов аминокислот в пептидах, что «открывает» пептидные связи первичной структуры белка.
-
В: Первая помощь при отравлении солями тяжелых металлов. Ответ поясните
О: Главная задача – предотвратить всасывание этих солей. Для этого внутрь вводят раствор природных белков. Чаще это молоко. Белки молока связываются с солями, что вызывает их денатурацию и они осаждаются на слизистую, уменьшая доступ солей к слизистой. После этого делают промывание.
-
В: Сколько глюкозы в норме в моче и почему?
О: В норме глюкозы в моче нет, т.к. она полностью реабсорбируется почечными канальцами. В первичной моче есть глюкоза, но затем она полностью реабсорбируется, причем реабсорбция идет путем активного транспорта, т.е. с затратой энергии. При хронической гипергликемии (9-10 ммоль/л) уменьшается процент реабсорбции этого соединения, т.к. не хватает энергии и может развиться глюкозурия.
-
В: Назовите фермент, принимающий участи в синтезе и распаде гликогена. Формулы реакций.
О:

Фермент – ФОСФОГЕКСОМУТАЗА.
21.В: Чем грозит ранее и неумеренное употребление легкоусвояемых углеводов у детей? Почему?
О: Легкоусвояемые углеводы детям можно давать с 5 лет. До этого срока нельзя, т.к. чревато:
а) диатез,
б) кариес,
в) в крови наблюдается гипергликемия – а значит выработка инсулина, что ведет к липогенезу в липоцитах - как следствие ожирение, в печени липогенез – жировая инфильтрация (перерождение) печени,
г) может развиться СД II типа,
д) увеличивается синтез ХС – атеросклероз,
е) увеличенное поступление ХС в печень, выводится с желчью, если его содержание в желчи превышено – осаждение, желчные камни.
-
В: Разница в использовании гликогена в мышцах и печени.
О:
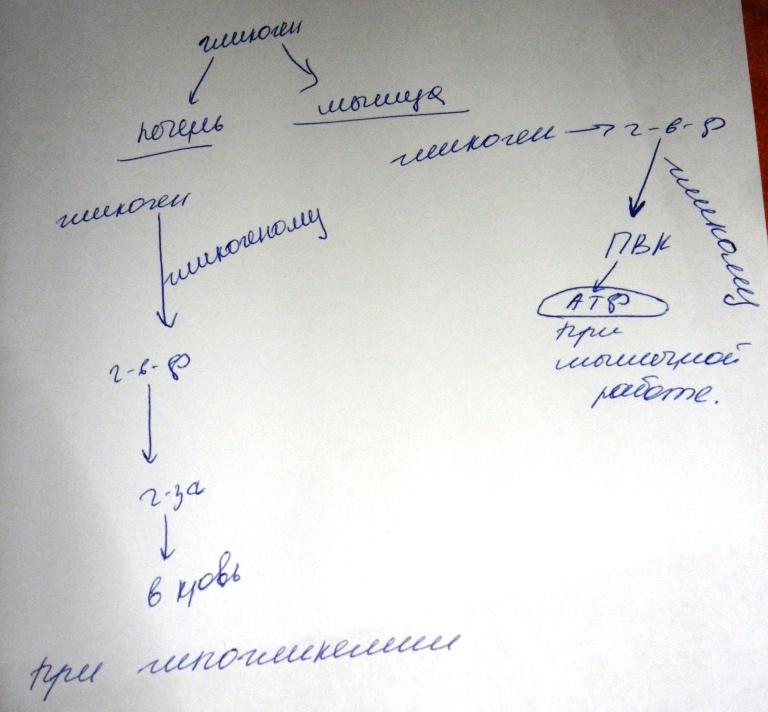
23.: Почему блок глюкозо-6-фосфатазы обуславливает стимуляцию синтеза гликогена? Пример патологии.
О: Дефицит глюкозо-6-фосфатазы составляет основу болезни Гирке, или гликогеноза типа 1. Недостаточность этого фермента приводит к невозможности превращения глюкозо-6-фосфата в глюкозу, что сопровождается накоплением гликогена в печени и почках. Болезнь наследуется по аутосомно-рецессивному типу.
Поступление глюкозы в организм с пищей, в принципе, дает возможность поддерживать в крови нормальный уровень глюкозы, однако для этого поступление пищи, содержащей глюкозу, должно быть практически непрерывным. В реальных условиях существования, т. е. при отсутствии непрерывного поступления глюкозы, в здоровом организме последняя депонируется в виде гликогена, который при необходимости используется при его полимеризации.
Первичное нарушение при болезни Гирке происходит на генетическом уровне. Оно состоит в полной или почти полной неспособности клеток продуцировать глюкозо-6-фосфатазу, обеспечивающую отщепление свободной глюкозы от глюкозо-6-фосфата. В результате этого гликогенолиз прерывается на уровне глюкозо-6-фосфата и дальше не идет. Дефосфорилирование с участием глюкозо-6-фосфатазы является ключевой реакцией не только гликогенолиза, но и глюконеогенеза, который, таким образом, при болезни Гирке также прерывается на уровне глюкозо-6-фосфата. Возникновение устойчивой гипогликемии, которая в реальных условиях неизбежна из-за непоступления в кровь глюкозы как конечного продукта гликогенолиза и глюконеогенеза, в свою очередь приводит к постоянной повышенной секреции глюкагона как стимулятора гликогенолиза. Глюкагон, однако, в условиях прерывания этого процесса способен лишь без пользы для организма непрерывно стимулировать его начальные стадии.
