
- •10.Химичское равновесие – состояние химической системы в котором обратимо протекает одна или несколько химических реакций при чем скорость и в каждой паре прямая – обратная реакция равны между собой.
- •14.Осмос в биологии и медицине - Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры.
- •15. Электролиты – это вещества, растворы и расплавы которых прово-дят электрический ток.
- •Типы протолитических реакций
- •Гидролиз белков, жиров, полисахаридов
- •19. Гидро́лиз — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений.
19. Гидро́лиз — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений.
В живых организмах происходит ферментативный гидролиз жиров. В кишечнике под влиянием фермента липазы жиры пищи гидратизуются на глицерин и органические кислоты, которые всасываются стенками кишечника, и в организме синтезируются новые жиры, свойственные данному организму. Они по лимфатической системе поступают в кровь, а затем в жировую ткань. Отсюда жиры поступают в другие органы и ткани организма, где в процессе обмена веществ в клетках опять гидролиэу-ются и затем постепенно окисляются до оксида углерода и воды с выделеиием энергии, необходимой для жизнедеятельности.
Факторы, влияющие на степень гидролиза.
Температура. Концентрация продуктов гидролиза. Концентрация соли. Разбавление.
(17 вопрос)
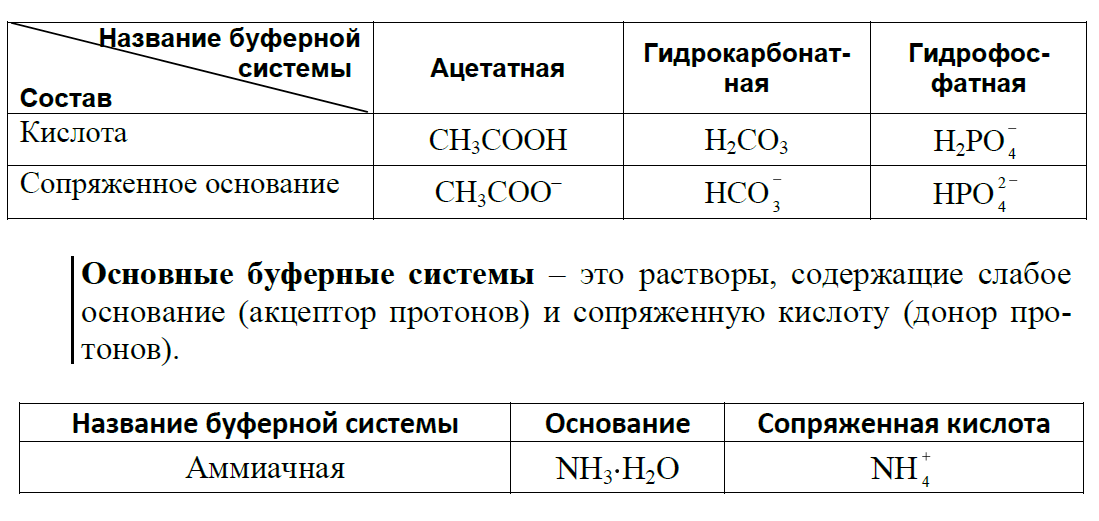
20. Буферная система – это раствор, содержащий протолитическую равновесную систему, способную поддерживать практически посто-янное значение рН при разбавлении или при добавлении небольших количеств кислоты или щелочи.
Кислотные
буферные
системы
–
это
растворы,
содержащие
слабую
кислоту
(донор
протонов)
и
сопряженное
основание
(акцептор
про
тонов).

26.Буферная емкость (В) – количество вещества эквивалента кислоты или щелочи, которое нужно добавить к 1 литру буферного раствора, чтобы изменить величину рН на единицу. Буферная емкость зависит от концентраций компонентов в буфер- ном растворе и их соотношения. Чем выше концентрация компонентов, тем большее количество приливаемых кислот и оснований может быть ими связано.
27.
28. Химические гетерогенные процессы включают в качестве этапа химические реакции, которые идут в одной из фаз после перемещения туда реагентов или на поверхности раздела фаз.
Гетерогенные равновесия в процессах перехода вещества из одной фазы в другую, не сопровождающиеся изменением химического состава этого вещества, принято называть фазовыми равновесиями.


29. Конкурирующие гетерогенные процессы: конкуренция за катион или анион Осаждение малорастворимых соединений идет дробно. Вначале осаждается наиболее трудно растворимое соединение, константа раство- римости которого достигается при наименьшей концентрации осаждаю- щего реагента, а затем осаждаются другие соединения в порядке возраста- ния их констант растворимости.
30. Смещение равновесия гетерогенных реакций подчиняется принципу Ле Шателье. При повышении температуры оно смещается в сторону эндотермической реакции. При повышении давления или концентрации исходных веществ равновесие смещается в сторону образования продуктов реакции, при повышении концентрации или давления продуктов реакции равновесие смещается в сторону обратной реакции. При повышении общего давления равновесие сдвигается в направлении уменьшения числа молекул газообразных веществ.
Твердые исходные вещества и продукты реакции не влияют на смещение гетерогенного химического равновесия.
При проведении в растворе таких реакций, которые могут привести к выделению осадка, существует определенное требование к значению аналитических концентраций реагентов − условие выпадения осадка.
Образование осадка малорастворимого сильного электролита МxАy произойдет только тогда, когда после смешивания растворов реагентов в конечном объеме смеси будет соблюдаться соотношение
(сMy+)x · (сАx−)y > ПР(MxAy)
где в круглых скобках стоят выбранные (по условию проведения опыта) молярные концентрации катионов и анионов в конечном растворе (после смешивания растворов реагентов).
Если условие выпадения осадка не выполняется, т.е. (сMy+)x · (сАx−)y < ПР(MxAy ), то образование осадка происходить не будет.
